题目内容
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
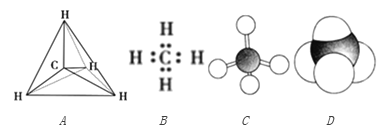
(1)甲烷的比例模型是________,甲烷的电子式是__________ (填序号)。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为100的烷烃的分子式是_______________。
(4)甲烷与丙烷互为________。
A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体
【答案】 D B CH4 + Cl2 ![]() CH3Cl + HCl 取代反应 C7H16 C
CH3Cl + HCl 取代反应 C7H16 C
【解析】试题分析:(1)比例模型能反映原子体积大小。
(2)甲烷与氯气发生取代反应生成一氯甲烷和氯化氢。
(3)根据烷烃通式![]() 计算相对分子质量为100的烷烃的分子式。
计算相对分子质量为100的烷烃的分子式。
(4)甲烷与丙烷结构相似、分子组成形成2个CH2原子团。
解析:(1)甲烷的比例模型是 ,故选C。甲烷的电子式是
,故选C。甲烷的电子式是![]() ,故选B;
,故选B;
(2)甲烷与氯气发生取代反应生成一氯甲烷和氯化氢,化学方程式为CH4 + Cl2 ![]() CH3Cl + HCl。
CH3Cl + HCl。
(3)根据烷烃通式![]() ,相对分子质量为100的烷烃,
,相对分子质量为100的烷烃,![]() ,n=7,分子式为C7H16。
,n=7,分子式为C7H16。
(4)甲烷与丙烷结构相似、分子组成形成2个CH2原子团,所以甲烷与丙烷互为同系物,故选C。

练习册系列答案
相关题目