题目内容
【题目】氮化钛是一种新型功能性材料,它可由钛粉和氮气在一定条件下进行制备。
(1)基态钛原子的核外电子排布式为________,1 mol N2中含有________molσ键。
(2)钛也可与C、O等元素形成二元化合物,C、N、O元素的电负性由大到小的顺序是________。
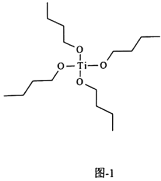
(3)氮化钛也可由钛酸四丁酯[Ti(OC4H9)4]为原料进行制备,钛酸四丁酯结构如图1。其中碳原子的杂化类型为________。该配合物中的配位原子为________。
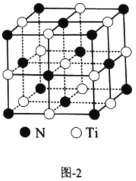
(4)有一种氮化钛晶体的晶胞如图2所示,该晶体的化学式为________。
【答案】1s22s22p63s23p63d24s2(或为[Ar] 3d24s2) 1 O>N>C sp3 O TiN
【解析】
(1)Ti是22号元素,根据构造原理,可得基态钛原子的核外电子排布式;N2分子中2个N原子形成3个共价键,共价三键中含有1个σ键,2个π键;
(2)元素的非金属性越强,其电负性就越大;
(3)根据原子形成的化学键数目判断其杂化类型;Ti原子具有空轨道,OC4H9中的O原子提供孤电子对;
(4)利用均摊方法计算晶体的化学式。
(1)Ti是22号元素,根据构造原理,可得基态钛原子的核外电子排布式为:1s22s22p63s23p63d24s2或简写为[Ar] 3d24s2;N2分子中2个N原子形成3个共价键,结构式是N≡N,2个N原子通过共价三键结合,其中含有1个σ键,2个π键,则1 mol N2中含有1 mol σ键;
(2)元素的非金属性越强,其电负性就越大。C、N、O是同一周期的元素,由于元素的非金属性:O>N>C,所以三种元素的电负性由大到小的顺序是:O>N>C;
(3)在络合物钛酸四丁酯[Ti(OC4H9)4]中,配位体OC4H9的C原子形成4个共价键,因此C原子杂化类型为sp3杂化;中心离子Ti4+提供空轨道,配位体OC4H9中的O原子提供孤对电子对,所以该配合物中的配位原子是O原子;
(4)根据晶胞结构可知:N原子数目为:8×![]() +6×
+6×![]() =4;含有的Ti原子数目为:12×
=4;含有的Ti原子数目为:12×![]() +1=4,所以该晶体的化学式为TiN。
+1=4,所以该晶体的化学式为TiN。

 名校课堂系列答案
名校课堂系列答案