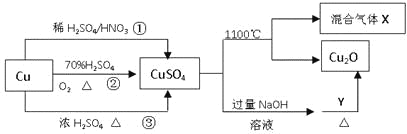
题目内容
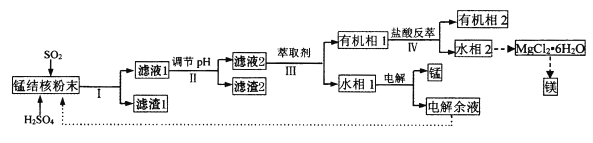
【题目】用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
已知:①几种难溶物的溶度积(25℃)如下表所示:
化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______,“滤渣2”的成分为______。
(3)“Ⅲ”处“萃取剂”萃取的成分是___;“Ⅳ”处用“盐酸反萃”的作用是____。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____。
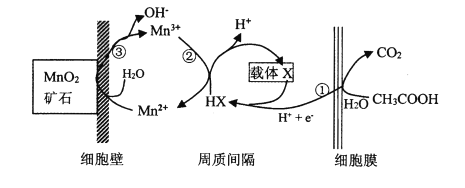
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________。
【答案】MnO2+SO2=Mn2++SO![]() 5≤pH<8 Fe(OH)3、Al(OH)3 Mg2+ 使Mg2+与萃取剂分离转化为MgCl2 抑制MgCl2水解 萃取剂或有机相2 MnO2+2HX=Mn2++2X+2OH-
5≤pH<8 Fe(OH)3、Al(OH)3 Mg2+ 使Mg2+与萃取剂分离转化为MgCl2 抑制MgCl2水解 萃取剂或有机相2 MnO2+2HX=Mn2++2X+2OH-
【解析】
锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)加入H2SO4进行酸浸,将MgO、Fe2O3、Al2O3转化为Mg2+、Fe3+、Al3+,并通入SO2将MnO2转化为Mn2+,自身被氧化为![]() ,SiO2不与二氧化硫和硫酸反应,则滤渣1中主要为SiO2,滤液1中主要含有Mg2+、Fe3+、Al3+、Mn2+及
,SiO2不与二氧化硫和硫酸反应,则滤渣1中主要为SiO2,滤液1中主要含有Mg2+、Fe3+、Al3+、Mn2+及![]() ,调节滤液1的pH值,使Fe3+、Al3+转化为Al(OH)3、Fe(OH)3过滤除去,则滤渣2主要含有Al(OH)3、Fe(OH)3,滤液2主要含有Mg2+、Mn2+及
,调节滤液1的pH值,使Fe3+、Al3+转化为Al(OH)3、Fe(OH)3过滤除去,则滤渣2主要含有Al(OH)3、Fe(OH)3,滤液2主要含有Mg2+、Mn2+及![]() 的溶液,向滤液2加入有机萃取剂,溶液分层,分液后有机相1中主要含有Mg2+,水相1中主要含有Mn2+及
的溶液,向滤液2加入有机萃取剂,溶液分层,分液后有机相1中主要含有Mg2+,水相1中主要含有Mn2+及![]() ,向有机相1中加入盐酸进行反萃取,Mg2+从有机相1转入水相2,形成含有MgCl2的酸性溶液,对水相2蒸发结晶得到MgCl26H2O,在干燥的HCl气流中加热分解得到MgCl2,再进行熔融电解得到金属镁,对水相1进行电解得到金属锰单质和H2SO4,电解后的溶液中含有H2SO4,可返回步骤Ⅰ酸浸使用,据此分析解答。
,向有机相1中加入盐酸进行反萃取,Mg2+从有机相1转入水相2,形成含有MgCl2的酸性溶液,对水相2蒸发结晶得到MgCl26H2O,在干燥的HCl气流中加热分解得到MgCl2,再进行熔融电解得到金属镁,对水相1进行电解得到金属锰单质和H2SO4,电解后的溶液中含有H2SO4,可返回步骤Ⅰ酸浸使用,据此分析解答。
(1)根据分析,“锰结核粉末”中MnO2与SO2反应,SO2将MnO2转化为Mn2+,自身被氧化为![]() ,离子方程式为MnO2+SO2=Mn2++SO
,离子方程式为MnO2+SO2=Mn2++SO![]() ;
;
(2)调节滤液1的pH值,使Fe3+、Al3+转化为Al(OH)3、Fe(OH)3过滤除去,“滤液1”中Mn2+、Mg2+不能形成沉淀,溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全,Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38,当Al3+完全沉淀时,Fe3+已经完全沉淀,此时溶液中c(OH-)= =1.0×10-9mol·L-1,pOH=9,则pH=14- pOH=5;根据Ksp[Mn(OH)2]= 1.8×10-13,Ksp[Mg(OH)2]= 1.8×10-11,当“滤液1”中c(Mn2+)为0.18mol·L-1时,溶液中c(OH-)=
=1.0×10-9mol·L-1,pOH=9,则pH=14- pOH=5;根据Ksp[Mn(OH)2]= 1.8×10-13,Ksp[Mg(OH)2]= 1.8×10-11,当“滤液1”中c(Mn2+)为0.18mol·L-1时,溶液中c(OH-)=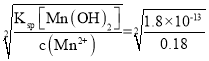 =1.0×10-6mol·L-1,pOH=6,则pH=14- pOH=8,则“调节pH”的范围为
=1.0×10-6mol·L-1,pOH=6,则pH=14- pOH=8,则“调节pH”的范围为
(3)根据分析,“Ⅲ”处“萃取剂”萃取的成分是Mg2+;“Ⅳ”处用“盐酸反萃”的作用是使Mg2+与萃取剂分离转化为MgCl2;
(4)MgCl2属于强酸弱碱盐,高温下,促进Mg2+发生水解生成Mg(OH)2,在干燥的HCl气流中加热分解,可以抑制MgCl2水解;
(5)根据分析,向有机相1中加入盐酸进行反萃取,Mg2+从有机相1转入水相2,分液后得到有机相2,即为萃取剂,则该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为萃取剂或有机相2;
(6)根据图示,反应②为:Mn3++ HX= Mn2++X+H+,反应③为:Mn2++ MnO2+2H2O=4OH-+2 Mn3+,②×2+③可得,反应②③的总反应的离子方程式MnO2+2HX=Mn2++2X+2OH-。

 阅读快车系列答案
阅读快车系列答案【题目】过氧化氢是重要的化工产品,广泛应用于化学合成、医疗消毒等领域。
(1)过氧化氢的电子式为_____________。
(2)工业上电解硫酸氢盐溶液得到过二硫酸盐(![]() ),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
),过二硫酸盐水解生成H2O2溶液和硫酸氢盐,生成的硫酸氢盐可以循环使用。电解硫酸氢盐溶液时阳极的电极反应式为_______。写出过二硫酸盐水解的离子方程式________。
(3)298K时,实验测得反应![]() 在不同浓度时的化学反应速率如表:
在不同浓度时的化学反应速率如表:
实验编号 | 1 | 2 | 3 | 4 | |
c(HI) /mol﹒L-1 | 0.100 | 0.200 | 0.300 | 00.100 | 0.100 |
c(H2O2)/mol﹒L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v//mol﹒L-1﹒s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
已知速率方程为![]() ,其中k为速率常数。
,其中k为速率常数。
根据表中数据判断:a=_______,b=________。
(4)“大象的牙膏”实验是将浓缩的过氧化氢与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。反应中H2O2的分解机理为:
![]() 慢
慢
![]() 快
快
此反应过程中无催化剂和有催化剂的能量变化关系图像如图所示:

则表示慢反应的曲线是__________(填“a”或“b”)。
1mol H2O2分解放出热量98 kJ,则H2O2分解的热化学方程式为_________________。
(5)某科研团队研究![]() 体系(其中
体系(其中![]() )氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:
)氧化苯乙烯制取苯甲醛,反应的副产物主要为苯甲酸和环氧苯乙烷。一定条件下,测得一定时间内温度对氧化反应的影响如图:

注:■苯乙烯转化率 ●苯甲醛选择性
①80℃时苯乙烯的转化率有所降低,其原因可能是_______。
②结合苯乙烯的转化率,要获得较高的苯甲醛产率,应该选择的温度为_______。