题目内容
6.下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )| A. | AlCl3与氨水 | B. | 铁与稀硝酸 | C. | HCl与Na2CO3 | D. | NaHCO3与Ca(OH)2 |
分析 A.氯化铝与氨水反应生成氢氧化铝沉淀,与反应物是否过量无关;
B.铁与稀硝酸的反应中,铁粉过量,反应生成亚铁离子,铁粉不足,反应生成铁离子;
C.盐酸不足时,反应生成碳酸氢钠,盐酸过量时,反应生成二氧化碳气体;
D.当氢氧化钙不足时,反应生成碳酸钙沉淀、氢氧化钠和水,当氢氧化钙不足时,反应生成碳酸钠、碳酸钙和水.
解答 解:A.氯化铝与氨水反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,与反应物是否过量无关,故A正确;
B.铁与稀硝酸的反应中,如果铁粉不足,反应生成铁离子,反应的离子方程式为:Fe+4H++NO3-═3Fe3++NO↑+2H2O;如果铁粉过量,则生成亚铁离子,反应的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,反应产物与反应物的量有关,反应的离子方程式不同,故B错误;
C.HCl与Na2CO3的反应中,若盐酸不足,反应生成的是碳酸氢钠,反应的离子方程式为:H++CO32-=HCO3-;若盐酸过量,反应生成二氧化碳气体,反应的离子方程式为:2H++CO32-=H2O+CO2↑,所以反应产物与反应物的量有关,则反应的离子方程式不同,故C错误;
D.NaHCO3与Ca(OH)2:当氢氧化钙不足时,反应生成碳酸钠、碳酸钙沉淀和水,反应的离子方程式为:2HCO3-+2OH-+Ca2+=CO32-+CaCO3↓+2H2O;当氢氧化钙过量时,反应生成碳酸钙、氢氧化钠和水,反应的离子方程式为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,反应物过量情况影响产物,则反应的离子方程式不同,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确反应物过量情况对生成物的影响情况为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 钙离子的结构示意图: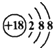 | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | CH4分子的球棍模型: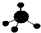 | D. | 丙烯的电子式: |
| A. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I是同一种核素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I互为同位素 | |
| C. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I都含有53个电子 | |
| D. | ${\;}_{53}^{131}$I和${\;}_{53}^{134}$I都含有53个中子 |
| A. | 用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | NH4HCO3溶液和过量的NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═FeS↓+2H+ | |
| D. | FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2═I2+2Cl- |
| A. | 用惰性电极电解饱和食盐水:C1-+2H2O═H2↑+Cl2↑+OH- | |
| B. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| A. | 第二周期第VA族 | B. | 第二周期第VIA族 | C. | 第三周期第VIA族 | D. | 第三周期第VA族 |
 甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题:
甲醇是一种低碳能源,在全球能源危机和环境污染的背景下具有良好的发展前景.在催化剂作用下可用H2和CO合成甲醇,反应的化学方程式为2H2(g)+CO(g) $\stackrel{催化剂}{?}$CH3OH(g),三种物质的物质的量浓度随时间变化的关系如图1所示.试回答下列问题: