题目内容
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
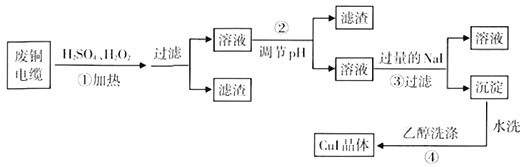
(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
【答案】 Cu+H2O2+H2SO4![]() CuSO4+2H2O 温度高于40℃时,H2O2分解,浓度减小,反应速率减慢 CD 4.2 2Cu2++4I-=2CuI↓+I2 先去晶体表面的水份或得到干燥的CuI
CuSO4+2H2O 温度高于40℃时,H2O2分解,浓度减小,反应速率减慢 CD 4.2 2Cu2++4I-=2CuI↓+I2 先去晶体表面的水份或得到干燥的CuI ![]()
【解析】试题分析:(1)过程①得到的溶液呈蓝色,说明Cu、H2O2、H2SO4反应生成CuSO4;
温度高于40℃时,H2O2分解,浓度减小;(2)过程②调节溶液pH的目的是除去Cu2+中的Fe3+;Fe(OH)3的Ksp=4×10-35计算完全除去Fe3+时的PH;(3)过程③的氧化产物能使淀粉变蓝,说明氧化产物是I2;(4) CuI不溶于乙醇,乙醇易挥发可以除去晶体表面的水份;(5)根据关系式CuI![]() Fe2(SO4)3
Fe2(SO4)3![]()
![]() KMnO4计算CuI的质量分数;
KMnO4计算CuI的质量分数;
解析:(1)过程①得到的溶液呈蓝色,说明Cu、H2O2、H2SO4反应生成CuSO4,反应方程式为Cu+H2O2+H2SO4![]() CuSO4+2H2O;温度高于40℃时,H2O2分解,浓度减小,所以反应速率减慢;(2) A、加入NaOH 引入新杂质Na+,故A错误; B.加入NH3·H2O引入新杂质NH4+,故B错误; C.加入CuO ,消耗氢离子,不引入杂质离子,故C正确; D. 加入CuCO3消耗氢离子,不引入杂质离子,故D正确;完全除去Fe3+时
CuSO4+2H2O;温度高于40℃时,H2O2分解,浓度减小,所以反应速率减慢;(2) A、加入NaOH 引入新杂质Na+,故A错误; B.加入NH3·H2O引入新杂质NH4+,故B错误; C.加入CuO ,消耗氢离子,不引入杂质离子,故C正确; D. 加入CuCO3消耗氢离子,不引入杂质离子,故D正确;完全除去Fe3+时![]() ,
, ![]() ,
, ![]() ,
, 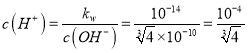 ,PH=-
,PH=- ![]() =4.2;(3)硫酸铜与碘化钠反应的氧化产物能使淀粉变蓝,说明氧化产物是I2,反应离子方程式是2Cu2++4I-=2CuI↓+I2;(4) CuI不溶于乙醇,乙醇易挥发可以除去晶体表面的水份,得到干燥的CuI;(5)设样品中CuI的质量为xg,根据关系式
=4.2;(3)硫酸铜与碘化钠反应的氧化产物能使淀粉变蓝,说明氧化产物是I2,反应离子方程式是2Cu2++4I-=2CuI↓+I2;(4) CuI不溶于乙醇,乙醇易挥发可以除去晶体表面的水份,得到干燥的CuI;(5)设样品中CuI的质量为xg,根据关系式
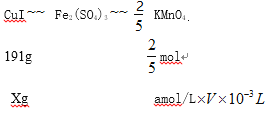
X=191g![]() amol/L
amol/L ![]()
![]() ;样品中CuI的质量分数为191g
;样品中CuI的质量分数为191g![]() amol/L
amol/L 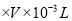
![]()
![]() =
=![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案