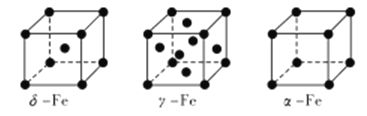
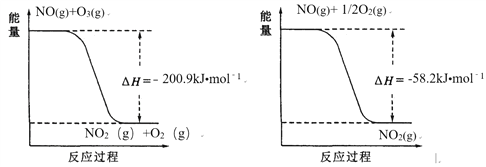
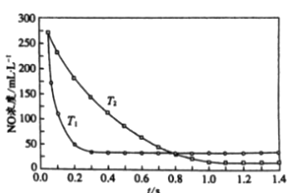
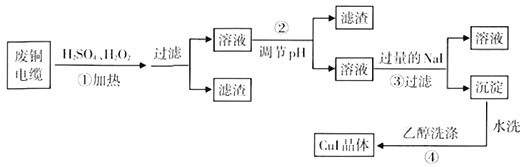
题目内容
【题目】下列说法正确的是( )
A. 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
B. 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO-)减小,但K不变。
C. 足量体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少
D. 25℃,在AgCl悬浊液中加入少量NaCl固体,c(Ag+)减小,Ksp(AgCl)减小
【答案】B
【解析】A项,H2O的电离方程式为H2O![]() H++OH-,加入NaHSO4固体,NaHSO4在水溶液中电离出Na+、H+、SO42-,c(H+)增大,但温度不变,KW不变,错误;B项,醋酸溶液加水稀释促进醋酸的电离,n(CH3COO-)增大,n(CH3COOH)减小,
H++OH-,加入NaHSO4固体,NaHSO4在水溶液中电离出Na+、H+、SO42-,c(H+)增大,但温度不变,KW不变,错误;B项,醋酸溶液加水稀释促进醋酸的电离,n(CH3COO-)增大,n(CH3COOH)减小,![]() =
=![]() 减小,由于温度不变,K不变,正确;C项,开始瞬间pH相同,开始瞬间醋酸和盐酸与镁粉反应速率相等,醋酸属于弱酸,存在电离平衡,后来镁粉与H+反应促进醋酸的电离,醋酸溶液中c(H+)大于盐酸中c(H+),镁粉与醋酸反应快,醋酸用时少,错误;D项,在AgCl悬浊液中存在溶解平衡:AgCl(s)
减小,由于温度不变,K不变,正确;C项,开始瞬间pH相同,开始瞬间醋酸和盐酸与镁粉反应速率相等,醋酸属于弱酸,存在电离平衡,后来镁粉与H+反应促进醋酸的电离,醋酸溶液中c(H+)大于盐酸中c(H+),镁粉与醋酸反应快,醋酸用时少,错误;D项,在AgCl悬浊液中存在溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),加入少量NaCl电离出Cl-,c(Cl-)增大,溶解平衡逆向移动,c(Ag+)减小,温度不变,Ksp(AgCl)不变,错误;答案选B。
Ag+(aq)+Cl-(aq),加入少量NaCl电离出Cl-,c(Cl-)增大,溶解平衡逆向移动,c(Ag+)减小,温度不变,Ksp(AgCl)不变,错误;答案选B。

练习册系列答案
相关题目