题目内容
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为______________________________________________。
Ⅱ.在一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:

(1)该反应的反应热ΔH_______0(填“>”或“<”),压强的相对大小:p1_______p2(填“>”或“<”)。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________________________________。
A.容器内气体压强不再变化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器内的密度不在变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下在保证H2浓度不变的情况下,增大容器的体积,平衡_________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是__________________________________________________________________。
【答案】 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51kJ·mol-1 < > K=48 BC C 保证c(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商![]() ,所以平衡不移动
,所以平衡不移动
【解析】Ⅰ.已知:① CH3OH(g)+H2O(l)=CO2(g)+3H2(g)ΔH=+93.0kJ·mol-1
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
③ CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
根据盖斯定律可知,②×3-①×2-③即得到甲醇的燃烧热的热化学方程式:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-726.51kJ·mol-1,故答案为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-726.51kJ·mol-1;
Ⅱ. (1).据图可知,随着温度的升高,CH3OH的体积分数逐渐减小,说明升高温度,平衡逆向移动,则该反应的正反应为放热反应,△H<0;因该反应的正反应是气体体积减小的反应,则增大压强,平衡正向移动,CH3OH的体积分数增大,即压强越大,CH3OH的体积分数越大,据图可知,压强为P1时CH3OH的体积分数大于压强为P2时CH3OH的体积分数,所以P1>P2,故答案为:<;>;
(2). 压强为P2,温度为300℃时,CH3OH的体积分数为50%,根据三段式法有:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol) 1 2 0
转化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
![]() ×100%=50%,解得x=0.75mol,则达到平衡时CO、H2、CH3OH的浓度分别为:0.125mol/L、0.25mol/L、0.375mol/L,所以平衡常数K=
×100%=50%,解得x=0.75mol,则达到平衡时CO、H2、CH3OH的浓度分别为:0.125mol/L、0.25mol/L、0.375mol/L,所以平衡常数K=![]() =48,故答案为48;
=48,故答案为48;
(3). A.该反应是反应前后气体体积变化的可逆反应,容器内气体压强不再变化,说明反应达到了平衡状态,故A正确;B.v(CO):c(H2):v(CO3OH)=1:2:1,因未指明是正反应速率还是逆反应速率,则不能说明反应达到了平衡状态,故B错误;C.因容器恒容且反应前后总质量不变,则容器内的密度始终不变,所以容器内的密度不再变化不能说明反应达到了平衡状态,故C错误; D.因该反应的气体总质量不变,而反应前后气体物质的量不相等,所以容器内混合气体的平均相对分子质量不再变化,说明反应达到了平衡状态,故D正确;E.容器内各组分的质量分数不再变化,说明反应达到了平衡状态,故E正确;答案选BC。
(4).某温度下在保证H2浓度不变的情况下,增大容器的体积,则c(CH3OH)与c(CO)同等倍数减小,根据浓度商的表达式![]() 可知,Qc不变,则平衡不移动,故答案为:C;保证c(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商
可知,Qc不变,则平衡不移动,故答案为:C;保证c(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商![]() ,所以平衡不移动。
,所以平衡不移动。

【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
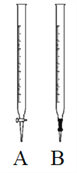
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。
(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。