题目内容
奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击发声的同时产生白色烟雾,反应的化学方程式为:5KC1O3+6P→3P2O5+5KC1。下列有关该反应的叙述中正确的是
| A.P2O5是还原产物 |
| B.发令时产生的白烟一定是KC1固体颗粒 |
| C.可以用白磷代替“火药”中的红磷 |
| D.反应消耗1mol P时转移的电子数为5mol |
D
解析试题分析:A、P2O5是氧化产物,错误;B、发令时产生的白烟还可能是固体颗粒P2O5(白色),错误;C、白磷着火点低,自燃,错误;危险;D、P →P2O51mol P转移的电子数为5mol,正确。
考点:考查氧化还原反应等相关知识。

练习册系列答案
相关题目
如图为反应Fe + CuSO4 ==FeSO4 + Cu中电子转移的关系图,则图中的元素甲、乙分别表示
| A.Fe Cu | B.Cu S | C.Fe O | D.Fe S |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O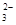 +O2+xOH—
+O2+xOH— Fe3O4+S4O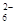 +2H2O,
+2H2O,
下列说法中,正确的是( )
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol ; |
| B.x="6" |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol; |
| D.Fe2+和S2O32—-都是还原剂; |
工业上粗硅的生产原理为2C+SiO2 Si+2CO↑,其中SiO2是
Si+2CO↑,其中SiO2是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
已知2Al+2NaOH+2H2O 2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
2NaAlO2+3H2。该反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)
| A.每生成0.3 mol H2,被还原的水分子数目为0.6 NA |
| B.当有2.7 g Al参加反应时,转移的电子数目为0.3 NA |
| C.每生成6.72 L的H2,溶液中AlO2-的数目就增加0.2 NA |
| D.溶液中每增加0.1 mol的AlO2-,Na+的数目就增加0.1 NA |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2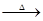 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列说法止确的是
| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入22.4 L SO2参加反应时,有2 NA个电子发生转移 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
| A.NaNO2发生氧化反应 |
| B.NH4Cl中的氮元素被还原 |
| C.N2既是氧化产物,又是还原产物 |
| D.每生成1mol N2转移电子的物质的量为6mol |