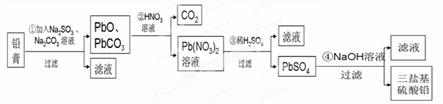
题目内容
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3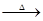 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2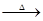 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列说法止确的是
| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |
B
解析试题分析:A、由方程式C3N3(OH)3 3HNCO可知,C3N3(OH)3与HNCO的化学式不同,反应属于化学变化,则C3N3(OH)3与HNCO为不同物质,故A错误;B、1mol HNCO与NO2反应时转移电子=1mol×[0-(-3)]=3mol,故B正确;C、HNCO在反应中N元素的化合价升高,则HNCO是还原剂,故C错误;D、该反应中碳元素的化合价不变,所以二氧化碳既不是氧化产物也不是还原产物,故D错误,答案选B。
3HNCO可知,C3N3(OH)3与HNCO的化学式不同,反应属于化学变化,则C3N3(OH)3与HNCO为不同物质,故A错误;B、1mol HNCO与NO2反应时转移电子=1mol×[0-(-3)]=3mol,故B正确;C、HNCO在反应中N元素的化合价升高,则HNCO是还原剂,故C错误;D、该反应中碳元素的化合价不变,所以二氧化碳既不是氧化产物也不是还原产物,故D错误,答案选B。
考点:考查氧化还原反应的有关判断和计算

 阅读快车系列答案
阅读快车系列答案已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体。②向NaI溶液中通入少量实验①产生的气体,溶液变黄色。③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是
| A.实验①证明Cl-具有还原性 |
| B.实验②中氧化剂与还原剂的物质的量之比为2∶1 |
| C.实验③说明KI被氧化 |
| D.上述实验证明氧化性:ClO3- > Cl2> I2 |
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.16mol/L | B.0.02mol/L | C.0.20mol/L | D.0.25mol?L?1 |
已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列变化不能发生的是
A.HCN H++CN- H++CN- | B.(CN)2 + CH2=CH2→ NC—CH2—CH2—CN |
| C.(CN)2+2Br-→ 2CN-+Br2 | D.(CN)2 + 2OH-→CN- + CNO- + H2O |
奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击发声的同时产生白色烟雾,反应的化学方程式为:5KC1O3+6P→3P2O5+5KC1。下列有关该反应的叙述中正确的是
| A.P2O5是还原产物 |
| B.发令时产生的白烟一定是KC1固体颗粒 |
| C.可以用白磷代替“火药”中的红磷 |
| D.反应消耗1mol P时转移的电子数为5mol |
不涉及氧化还原反应的是
| A.海水提镁 | B.明矶净水 | C.工业固氮 | D.电池充电 |
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素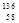 Ce、 Ce、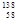 Ce、 Ce、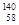 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
已知R有多种化合价,其最高正价为+7价。在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第VA族 |
| B.RO3-中的R只能被还原 |
| C.R-离子的最外层电子数为8 |
| D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5mol |