题目内容
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O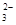 +O2+xOH—
+O2+xOH— Fe3O4+S4O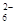 +2H2O,
+2H2O,
下列说法中,正确的是( )
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol ; |
| B.x="6" |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol; |
| D.Fe2+和S2O32—-都是还原剂; |
D
解析试题分析:根据氢原子守恒或氧原子守恒或电荷守恒,都可推出X=4,B项错误;分析反应中元素的化合价变化,3mol Fe2+反应时,2molFe2+被氧化失2mole-, 2molS2O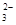 生成1molS4O
生成1molS4O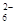 失2mol e-,共转移4mol e-,故A项错误,D项正确;根据电子得失可知,1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/4mol。
失2mol e-,共转移4mol e-,故A项错误,D项正确;根据电子得失可知,1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/4mol。
考点:本题考察氧化还原反应及化学反应中的守恒关系。

练习册系列答案
相关题目
下列物质与水反应过程中,水得到电子的是( )
| A.二氧化氮 | B.氯气 | C.钠 | D.氨气 |
在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为
| A.3∶1 | B.1∶3 | C.1∶2 | D.2∶1 |
As2S3和HNO3有如下反应:As2S3+10HNO3 2H3AsO4+3S+10NO2+2H2O,下列说法正确的是
| A.该反应的氧化产物仅为S |
| B.生成1molH3AsO2时。转移电子个数为10NA |
| C.将反应设计成一原电池,则NO2应该在正极附近逸出 |
| D.反应产生的NO2与56LO2混合在水中正好完全反应生成硝酸 |
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.16mol/L | B.0.02mol/L | C.0.20mol/L | D.0.25mol?L?1 |
高锰酸钾溶液在酸性条件下可以与亚铁离子反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
下列有关说法正确的是( )
| A.MnO4-和H+是氧化剂,Fe2+是还原剂 |
| B.H2O既是氧化产物又是还原产物 |
| C.每生成1mol水将转移1.2 mol的电子 |
| D.Fe2+的还原性强于Mn2+ |
奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击发声的同时产生白色烟雾,反应的化学方程式为:5KC1O3+6P→3P2O5+5KC1。下列有关该反应的叙述中正确的是
| A.P2O5是还原产物 |
| B.发令时产生的白烟一定是KC1固体颗粒 |
| C.可以用白磷代替“火药”中的红磷 |
| D.反应消耗1mol P时转移的电子数为5mol |
在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为( )
SiC+2CO↑反应中,氧化剂和还原剂的质量比为( )
| A.36∶30 | B.60∶36 | C.2∶1 | D.1∶2 |