题目内容
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
| A.滴加KI溶液时,KI被氧化,CuI是氧化产物 |
| B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| C.通入22.4 L SO2参加反应时,有2 NA个电子发生转移 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
D
解析试题分析:A、铜元素的化合价从+2价降低到+1价得到1个电子,发生还原反应,CuI是还原产物,A不正确;
B、反应中碘元素的化合价从-1价升高到0价,生成单质碘。碘单质具有氧化性,能把SO2氧化生成硫酸,而单质碘又被还原生成碘离子,因此溶液变成无色,B不正确;
C、由于不能确定SO2气体的状态,因此不能计算反应中转移电子的物质的量,C不正确;
D、根据氧化还原反应中氧化剂的氧化剂的氧化性强于氧化产物的可知,氧化性强弱顺序是Cu2+>I2>SO2,D正确,答案选D。
考点:考查氧化还原反应的有关判断和计算

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为
| A.3∶1 | B.1∶3 | C.1∶2 | D.2∶1 |
高锰酸钾溶液在酸性条件下可以与亚铁离子反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
下列有关说法正确的是( )
| A.MnO4-和H+是氧化剂,Fe2+是还原剂 |
| B.H2O既是氧化产物又是还原产物 |
| C.每生成1mol水将转移1.2 mol的电子 |
| D.Fe2+的还原性强于Mn2+ |
奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击发声的同时产生白色烟雾,反应的化学方程式为:5KC1O3+6P→3P2O5+5KC1。下列有关该反应的叙述中正确的是
| A.P2O5是还原产物 |
| B.发令时产生的白烟一定是KC1固体颗粒 |
| C.可以用白磷代替“火药”中的红磷 |
| D.反应消耗1mol P时转移的电子数为5mol |
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2 |
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+=Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素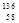 Ce、 Ce、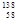 Ce、 Ce、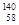 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是:( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为( )
SiC+2CO↑反应中,氧化剂和还原剂的质量比为( )
| A.36∶30 | B.60∶36 | C.2∶1 | D.1∶2 |
 →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O