题目内容
19.下列有关离子方程式书写正确的( )| A. | 向含1molFeI2溶液中通入标准状况下22.4LCl22Fe2++2I-+2Cl2=2Fe3++I2+2Cl- | |
| B. | 在Na2S溶液中滴加少量FeCl3 2Fe3++S2-═2Fe2++S↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO${\;}_{3}^{-}$ |
分析 A.碘离子还原性强于二价铁离子,氯气少量先氧化碘离子;
B.反应生成硫化亚铁和硫单质;
C.反应生成氢氧化铝和氯化铵;
D.反应生成亚硫酸钠.
解答 解:A.向含1molFeI2溶液中通入标准状况下22.4LCl2,氯气少量只氧化碘离子,离子方程式:2I-+Cl2=I2+2Cl-,故A错误;
B.在Na2S溶液中滴加少量FeCl3,离子方程式 2Fe3++3S2-═2FeS+S↓,故B错误;
C.氯化铝溶液中加入过量氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+SO32-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意化学式的拆分,注意得失电子守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.金属材料在日常生活以及生产中有着广泛的应用.下列关于金属的一些说法不正确的是( )
| A. | 合金的熔点比单一金属的熔点低,硬度大 | |
| B. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 | |
| C. | 工业上金属Mg、Cu都是用热还原法制得的 | |
| D. | 越活泼的金属越难冶炼 |
7.合理利用二氧化碳,可以提高生活质量,促进工业发展.在常压下,-78℃时,二氧化碳气体凝结成固态二氧化碳,俗称干冰.某学生买回一盒冰淇淋月饼,盒里有很多作为致冷剂的碎干冰.下列关于干冰处理的正确做法是.( )
| A. | 将干冰放入冰箱 | B. | 让干冰在通风处自然升华 | ||
| C. | 直接将干冰倒入下水道 | D. | 用手取干冰扔入废物箱 |
4.只用一种试剂即可区别苯、甲苯、四氯化碳、氢氧化钠溶液,此试剂是( )
| A. | 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 浓硫酸 | D. | 液溴 |
11.有关有机化合物分子式或结构的测定,下列叙述不合理的是( )
| A. | 根据燃烧产物中元素的种类可以确定有机化合物中所含元素的种类 | |
| B. | 利用质谱仪记录的质谱图可以精确测定该有机化合物的相对分子质量 | |
| C. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团类别 | |
| D. | 利用核磁共振仪记录的核磁共振氢图可以确定该有机化合物中氢原子的类型 |
9.短周期元素X、Y、Z、W的原子序数一次增大,X与Z、Y与W分别处于同一主族.X可分别与其他三种元素形成化合物.Z为同周期内原子半径最大的元素(稀有气体元素除外).Z、Y形成的某化合物跟Z、W形成的某化合物的摩尔质量相等.下列说法正确的是( )
| A. | 四种元素的最高正化合价都等于其所在的族序数 | |
| B. | X与Y、X与W分别形成的简单阴离子对水的电离的影响相似 | |
| C. | Z2W溶液呈碱性的原因可表示为W2-+2H2O?H2W+2OH- | |
| D. | X与Y、Y与Z均可形成具有强氧化性的化合物 |


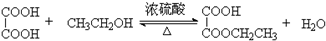 .
.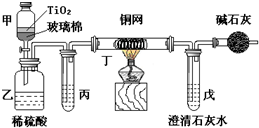 电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.