题目内容
17.(1)钢铁工业对促进经济和社会发展起了重要作用.①炼钢时,加入硅、锰和铝的目的是脱氧和调整钢的成分.
②炼铁和炼钢生产中,尾气均含有的主要污染物是CO.
(2)纯碱是一种重要的化工原料.目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺.
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:2NH4Cl+Ca(OH)2△_△––––––2NH3↑+CaCl2+2H2O;
②写出“联合制碱法”有关反应的化学方程式:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3△_△––––––Na2CO3+CO2↑+H2O;(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl);
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?“氨碱法”CO2来源于灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气.
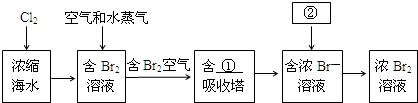
(3)浩瀚的海洋是一个巨大的资源宝库,蕴藏着富饶的矿产,是宝贵的化学资源,如图是从浓缩海水中提取溴的流程图.写出下图中①②的化学式:①SO2,②Cl2,吸收塔中发生的化学反应方程式为SO2+Br2+2H2O=H2SO4+2HBr.
分析 (1)①炼钢时,加入硅、锰和铝主要是可以脱氧和调整钢的成分;
②炼铁和炼钢生产中,尾气均含有的主要污染物CO,可用于燃料;
(2)①氨碱法是由氯化铵和消石灰在加热条件下反应后生成氨气和氯化钙的反应;
②联合制碱法是在氨的饱和NaCl溶液中二氧化碳气体,反应生成碳酸氢钠,解热碳酸氢钠即可制备碳酸钠;
③CO2是制碱工业的重要原料,氨碱法中CO2来源于石灰石煅烧,联合制碱法中CO2的来源于合成氨工业的废气;
(3)从浓缩海水中提取溴,先进行溴离子的氧化得到溴单质,利用二氧化硫吸收溴单质富集得到溴离子,最后再次用氯气氧化.
解答 解:(1)①炼钢时,加入硅、锰和铝,可与氧气反应,且能改变合金的性质,起到脱氧和调整钢的成分的作用,故答案为:脱氧和调整钢的成分;
②炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂同时还是一种燃料,
故答案为:CO;燃料(或还原剂);
(2)①氨碱法是由氯化铵和消石灰在加热条件下反应后生成氨气和氯化钙的反应,反应的化学方程式为2NH4Cl+Ca(OH)2△_△––––––2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2△_△––––––2NH3↑+CaCl2+2H2O;
②联合制碱法是在氨的饱和NaCl溶液中二氧化碳气体,反应生成碳酸氢钠,解热碳酸氢钠即可制备碳酸钠,反应的有关方程式为NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3△_△––––––Na2CO3+CO2↑+H2O;(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl),
故答案为:NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl;2NaHCO3△_△––––––Na2CO3+CO2↑+H2O;(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl);
③CO2是制碱工业的重要原料,氨碱法中CO2来源于石灰石煅烧,联合制碱法中CO2的来源于合成氨工业的废气,
故答案为:“氨碱法”CO2来源于灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气;
(3)从浓缩海水中提取溴,先进行溴离子的氧化得到溴单质,利用二氧化硫吸收溴单质的富集得到溴离子,最后再次用氯气氧化,吸收塔中发生的化学反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr;
故答案为:SO2;Cl2;SO2+Br2+2H2O=H2SO4+2HBr.
点评 本题考查目前制碱工业主要有“氨碱法”和“联合制碱法”以及海水提溴工艺的实验设计,题目难度较大,易出错点为化学方程式的书写,注意把握反应的原理,注重相关基础知识的积累.

 阅读快车系列答案
阅读快车系列答案| A. | 将干冰放入冰箱 | B. | 让干冰在通风处自然升华 | ||
| C. | 直接将干冰倒入下水道 | D. | 用手取干冰扔入废物箱 |
| A. | 标准状况下,22.4L盐酸含有NA个HCl分子 | |
| B. | 0.1 mol•L-1CH3COOH溶液中含有0.1NA个CH3COO- | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na2O2,失去个2NA电子 |
| A. | 0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA | |
| B. | 12.8g Cu与足量HNO3反应生成NO和NO2,转移电子数目为0.4 NA | |
| C. | 0.1 mol/L的Na2CO3溶液中CO32-的个数小于0.1NA | |
| D. | 1 mol SiO2晶体中含有NA个SiO2分子 |
| A. | 四种元素的最高正化合价都等于其所在的族序数 | |
| B. | X与Y、X与W分别形成的简单阴离子对水的电离的影响相似 | |
| C. | Z2W溶液呈碱性的原因可表示为W2-+2H2O?H2W+2OH- | |
| D. | X与Y、Y与Z均可形成具有强氧化性的化合物 |
| A. | 室温下,能将浓硫酸盛放在铁桶中 | |
| B. | NH4F溶液能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |

 电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.
电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率. 无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空: