题目内容
8.下列事实不能用平衡移动原理解释的是( )| A. | 蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 用加热蒸干AlCl3溶液的办法不能制得无水AlCl3 |
分析 夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.水的电离是可逆反应,向水中加入NaOH溶液时,溶液中氢氧根离子浓度增大,抑制水的电离,所以蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者,能用平衡移动原理解释,故A不选;
B.存在平衡2NO2?N2O4,加压后容器体积减小,二氧化氮浓度增大,所以颜色加深,但增大压强平衡向正反应方向移动,所以气体颜色会变浅,看到的现象是先变深后变浅,能用平衡移动原理解释,故B不选;
C.催化剂只影响反应速率不影响平衡移动,所以加入催化剂不能用平衡移动原理解释,故C选;
D.加热氯化铝溶液时,氯化铝水解生成氢氧化铝和盐酸,升高温度促进盐酸挥发,从而促进氯化铝水解,蒸干溶液得到氢氧化铝而不是氯化铝,可以用平衡移动原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,明确勒夏特里原理内涵是解本题关键,注意其适用条件及范围,只有改变条件能使平衡移动的可逆反应才能用平衡移动原理解释,易错选项是C.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
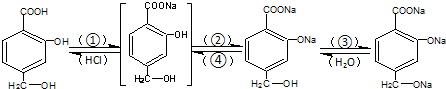
17.将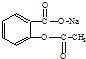 转变为
转变为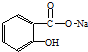 的方法正确的是( )
的方法正确的是( )
 转变为
转变为 的方法正确的是( )
的方法正确的是( )| A. | 与足量的NaOH溶液共热后,再通入足量的CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| C. | 与足量的NaOH溶液共热后,加入足量的稀H2SO4 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
3.下列关于乙醇的说法不正确的是( )
| A. | 能使酸性KMnO4溶液褪色 | B. | 可由乙烯通过加成反应制取 | ||
| C. | 与乙醛互为同分异构体 | D. | 通过取代反应可制取乙酸酯 |
13.下列反应中需要加入还原剂才能进行的是( )
| A. | H2→H2O | B. | Zn→Zn2+ | C. | Fe3+→Fe2+ | D. | CuO→CuCl2 |
20.类比是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观事实.下列各种类比推测的说法中正确的是( )
| A. | 已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS | |
| B. | 已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2 | |
| C. | 已知Br2与Fe反应生成FeBr3,推测I2与Fe生成FeI3 | |
| D. | 已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 |
18.Al,Fe,Cu都是重要的金属元素.下列说法正确的是( )
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中只生成氧化物 | |
| C. | 制备FeCl3不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3溶液是阴极上析出Al |