题目内容
8.工业上用甲苯生产对-羟基苯甲酸乙酯:,下列反应①-⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明).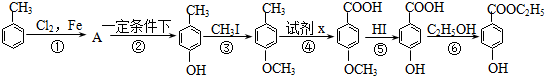
回答下列问题:
(1)有机物A的结构简式为
 .
.(2)反应②的化学方程式是:
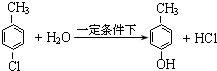 .
.(3)试剂x是酸性KMnO4溶液,反应⑥的反应类型是酯化反应.
(4)反应⑤的化学方程式是:
 .
.(5)合成路线中设计③、⑤两步反应的目的是保护酚羟基,使之不被氧化.
分析 反应①是甲苯与Cl2在铁粉作催化剂的条件下发生苯环上的取代反应,从反应②的产物可知反应②是一个卤代烃的水解反应,可推出有机物A为 ,反应③是将酚羟基中氢被甲基取代,反应⑤是将甲氧基又变为酚羟基,比较
,反应③是将酚羟基中氢被甲基取代,反应⑤是将甲氧基又变为酚羟基,比较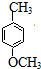 和
和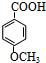 的结构可知,反应④是将甲基氧化成羧基的反应,所以试剂X为酸性高锰酸钾溶液,从④是氧化反应知,反应③和⑤的目的是保护酚羟基,防止被氧化,据此答题.
的结构可知,反应④是将甲基氧化成羧基的反应,所以试剂X为酸性高锰酸钾溶液,从④是氧化反应知,反应③和⑤的目的是保护酚羟基,防止被氧化,据此答题.
解答 解:反应①是甲苯与Cl2在铁粉作催化剂的条件下发生苯环上的取代反应,从反应②的产物可知反应②是一个卤代烃的水解反应,可推出有机物A为 ,反应③是将酚羟基中氢被甲基取代,反应⑤是将甲氧基又变为酚羟基,比较
,反应③是将酚羟基中氢被甲基取代,反应⑤是将甲氧基又变为酚羟基,比较 和
和 的结构可知,反应④是将甲基氧化成羧基的反应,所以试剂X为酸性高锰酸钾溶液,从④是氧化反应知,反应③和⑤的目的是保护酚羟基,防止被氧化,
的结构可知,反应④是将甲基氧化成羧基的反应,所以试剂X为酸性高锰酸钾溶液,从④是氧化反应知,反应③和⑤的目的是保护酚羟基,防止被氧化,
(1)根据上面的分析可知,A为 ,
,
故答案为: ;
;
(2)反应②的化学方程式是: ,
,
故答案为: ;
;
(3)根据上面的分析可知,试剂x是酸性KMnO4溶液,反应⑥是羧基与乙醇反应生成酯基,所以其反应类型是酯化反应,
故答案为:酸性KMnO4溶液;酯化;
(4)反应⑤的化学方程式是 ,
,
故答案为: ;
;
(5)根据上面的分析可知,合成路线中设计③、⑤两步反应的目的是保护酚羟基,使之不被氧化,
故答案为:保护酚羟基,使之不被氧化.
点评 本题考查有机化学推断,难度注定要,题目中有一个隐含条件在推断过程中,即羟基与HI反应生成了甲氧基,此反应反过来也能发生,所以HI起到了能保护羟基的作用.在做此类题目的时候,注意发生反应的官能团以及官能团的位置.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
18.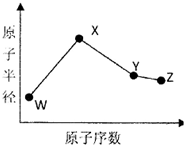 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构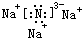 .
.
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
①0min~10min,W2的平均反应速率0.02mol/(L•min).
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.(1)Y在周期表中的位置是第三周期第ⅥA族.
(2)用电子式表示化合物X3W的结构
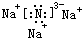 .
.(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是Na3N+3H2O=NH3↑+3NaOH.
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a>b(填“>”或“<”或“=”).
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ•mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mo1/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第l0min改变了反应条件,改变的条件可能是ab.
a.更新了催化剂b.升高温度c.增大压强d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是b.
a.更新了催化剂b.升高温度c.增大压强d.减小A的浓度.
19.下列物质:①丙氨酸 ②纤维素 ③蛋白质 ④小苏打 ⑤Al(OH)3 ⑥苯酚钠 ⑦CH3COONH4.其中既能与盐酸反应又能与NaOH反应的是( )
| A. | ①③④⑤⑦ | B. | 全部 | C. | ①③④⑤⑥ | D. | ①④⑤⑥ |
16.下列说法正确的是( )
| A. | CH4能使酸性KMnO4溶液褪色 | |
| B. | 金属Na能与C2H5OH中的甲基反应生成H2 | |
| C. | 乙酸有强烈的刺激性气味,其水溶液称为冰醋酸 | |
| D. | CH3CH2CH2CH3与CH3CH(CH3)2互为同分异构体 |
3.某同学设计下列方法对A盐的水溶液进行鉴定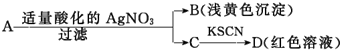
由此得出的结论中,不正确的是( )

由此得出的结论中,不正确的是( )
| A. | A一定是FeBr3 | B. | B为AgBr | ||
| C. | 滤液C中有Fe3+ | D. | D溶液中存在Fe(SCN)3 |
13.短周期元素A、B、C、D在周期表中的位置关系如图所示.已知在同周期元素的常见简单离子中,D的离子半径最小,E是周期表中半径最小的原子
回答下列问题:
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为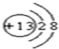
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为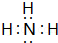 ,Y的结构式为
,Y的结构式为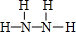 .
.
(3)A、B、C元素的氢化物均有两种或两种以上.在一定条件下A2E4与E2C可发生反应,化学方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
(4)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(5)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
| A | B | C | |
| D |
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为

(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
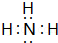 ,Y的结构式为
,Y的结构式为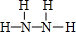 .
.(3)A、B、C元素的氢化物均有两种或两种以上.在一定条件下A2E4与E2C可发生反应,化学方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
(4)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(5)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
20.为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是( )
| A. | NaClO溶液的漂白原理与SO2相同 | |
| B. | 1 mol Cl2与足量NaOH溶液反应转移2 mol电子 | |
| C. | NaClO溶液的消毒原理是其强氧化性使蛋白质变性 | |
| D. | “84”消毒液与“洁厕灵”(盐酸)共同使用可达到既清洁又消毒的双重效果 |
17.将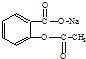 转变为
转变为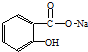 的方法正确的是( )
的方法正确的是( )
 转变为
转变为 的方法正确的是( )
的方法正确的是( )| A. | 与足量的NaOH溶液共热后,再通入足量的CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| C. | 与足量的NaOH溶液共热后,加入足量的稀H2SO4 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |