题目内容
13.把4.6g钠投入到95.4g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是( )| A. | 4.6% | B. | 7.91% | C. | 8.00% | D. | 8.02% |
分析 钠投入到水中,发生反应方程式为:2Na+2H2O=2NaOH+H2↑,根据反应的化学方程式计算生成NaOH的质量氢气质量,溶液的质量=钠的质量+水的质量-氢气质量,进而计算溶质的质量分数.
解答 解:将4.6g钠投入到95.4g水中,则:
2Na+2H2O=2NaOH+H2↑
46g 80g 2g
4.6g m(NaOH) m(H2)
m(NaOH)=$\frac{4.6g×80g}{46g}$=8.0g,
m(H2)=$\frac{4.6g×2g}{46g}$=0.2g,
则w(NaOH)=$\frac{8g}{4.6g+95.4g-0.2g}$×100%=8.02%,
故选D.
点评 本题考查化学方程式是计算、溶液质量分数的计算,题目难度不大,注关键是计算溶液质量.

练习册系列答案
相关题目
3.某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如表实验:
(1)实验1中能发生反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图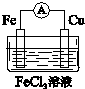 .
.
②该电池的正极反应为2Fe3++2e-=2Fe2+.
| 实验1 | 常温时取四种金属少量分别放入装有蒸馏水的试管中 |
| 实验2 | 再取少量铝、铁、铜分别放入装有稀硫酸的试管中 |
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是铝、铁均产生气泡且铝稍快些,铜不产生气泡.
结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;请从原子结构角度解释钠的还原性强于铝Na、Al同属于第三周期Na原子半径大于Al.
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液逐滴加入过量的NaOH溶液
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是bc.
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗.
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置.
①画出原电池的装置图
 .
.②该电池的正极反应为2Fe3++2e-=2Fe2+.
4.下列说法中正确的是( )
| A. | 食盐水在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质的水溶液的导电能力一定比弱电解质的水溶液的导电能力强 | |
| C. | 电解质溶液中已电离的离子和未电离的分子可以共存 | |
| D. | 电解质溶液的导电过程,与金属导体相同,都是物理过程 |
1.下列气体不能用浓H2SO4干燥的是( )
| A. | CO2 | B. | NH3 | C. | SO2 | D. | HCl |
18.下列叙述正确的是( )
| A. | 铜丝能导电,所以铜是电解质 | |
| B. | 固体氯化钠不导电,所以氯化钠不是电解质 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 氯化氢水溶液能导电,所以氯化氢是电解质 |
2.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
| A. | Fe3+、K、Fe2+ | B. | Cl-、Al、H2 | C. | NO2、Na+、Br2 | D. | O2、SO2、Fe |
3.下列说法中不正确的是( )
| A. | 人体缺碘,可通过食用加碘盐补碘 | |
| B. | 缺铁性贫血,可通过食用铁强化酱油预防 | |
| C. | 为了防止龋齿,人人都要长期吃口香糖 | |
| D. | 儿童缺锌可导致生长发育不良,抵抗力差,食欲不振 |
 .
.