题目内容
2.下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )| A. | Fe3+、K、Fe2+ | B. | Cl-、Al、H2 | C. | NO2、Na+、Br2 | D. | O2、SO2、Fe |
分析 判断物质的氧化性和还原性,需从两个反面入手,1.熟悉物质的性质,2.物质所含元素的化合价,如果物质所含元素处于中间价态,则物质既有氧化性又有还原性,处于最低价,只有还原性,处于最高价,只有氧化性.
解答 解:A、Fe3+处于最高价只有氧化性,K化合价处于最低价,K化合价只能升高,所以金属钾只有还原性,Fe2+处于中间价态,则物质既有氧化性又有还原性,故A正确;
B、Cl-化合价处于最低价只有还原性,Al处于最低价只有还原性,H2处于中间价态,则物质既有氧化性又有还原性,故B错误;
C、二氧化氮和水的反应说明二氧化氮既有氧化性又有还原性,Na+处于最高价只有氧化性,溴单质既有氧化性又有还原性,故C错误;
D、O2处于中间价态,则物质既有氧化性又有还原性,二氧化硫中硫元素居于中间价,既有氧化性又有还原性,Fe处于最低价只有还原性,故D错误.
故选A.
点评 本题主要考查对氧化性和还原性的判断和理解.氧化性是指物质得电子的能力,处于高价态的物质一般具有氧化性.还原性是在氧化还原反应里,物质失去电子或电子对偏离的能力,金属单质和处于低价态的物质一般具有还原性.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
12.酸性条件下,高锰酸钾与草酸钾反应的离子方程为:MnO4-+C2O42-+H+→CO2↑+Mn2++ .关于此反应的叙述正确的是( )
| A. | 配平该反应后,H+的系数是8 | B. | 该反应右边方框内的产物是OH- | ||
| C. | 该反应电子转移总数是5e- | D. | 该反应的还原剂是C2O42- |
13.把4.6g钠投入到95.4g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是( )
| A. | 4.6% | B. | 7.91% | C. | 8.00% | D. | 8.02% |
10.下列变化过程中,需要加入还原剂才能实现的是( )
| A. | Fe→FeSO4 | B. | SO2→S | C. | CO→CO2 | D. | HCl→Cl2 |
17.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4含有4NA个共价键 | |
| B. | 1mol D2O所含的电子总数为12NA | |
| C. | 常温下,23g NO2含有NA个氧原子 | |
| D. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
7.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 室温下体积为10L、pH=13的NaOH溶液中含有OH-的数目为NA | |
| B. | 常温常压下,17g氨气中含有氢原子的数目为NA | |
| C. | PH=1的醋酸溶液中,醋酸分子的个数为NA | |
| D. | 体积为1L、物质的量浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
11.已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增大,H+浓度减小,可加入( )
| A. | Na2SO3固体 | B. | 水 | C. | CaCO3固体 | D. | NaOH固体 |
12.下列叙述中正确的是( )
| A. | ${\;}_{17}^{37}$Cl的中子数为37 | B. | H2O与D2O互称同素异形体 | ||
| C. | NH3的电子式为 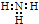 | D. | 1H与D互称同位素 |