题目内容
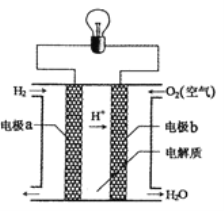
【题目】氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述不正确的是( )
2AlN+3CO合成。下列叙述不正确的是( )
A.AlN中N元素显-3价B.上述反应中CO是氧化产物
C.上述反应中Al2O3是还原剂D.上述反应中碳发生氧化反应
【答案】C
【解析】
反应中N元素化合价从0价降低到-3价,得到电子,发生还原反应,C元素化合价从0价升高到+2价,失去电子,发生氧化反应,据此分析判断。
A. 反应中N元素化合价从0价降低到-3价,AlN中N元素显-3价,A项正确,不符合题意;
B. 反应中C元素化合价从0价升高到+2价,因此CO是氧化产物,B项正确,不符合题意;
C. 在反应中Al2O3中所有元素化合价均未发生变化,既不是氧化剂也不是还原剂,C项错误,符合题意;
D. 反应中C元素化合价从0价升高到+2价,失去电子,发生氧化反应,D项正确,不符合题意;
答案选C。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)B单质与水反应的离子方程式 ______________________;
(3)下列表述中能证明元素D的非金属性比A强这一事实的是 _____________(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.一定条件下D和A的单质都能与钠反应
c.A最高价含氧酸的酸性弱于D最高价含氧酸
d.D单质能与A的氢化物反应生成A单质
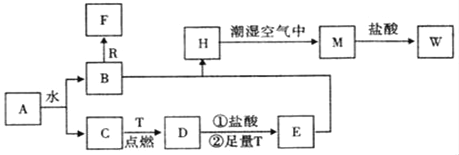
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _________,试写出Y与H2O2溶液反应的离子方程式: __________________
②若Z是红棕色气体,则Z→W的反应中还原剂与氧化剂物质的量之比为_________。
【题目】已知:AlO+HCO+H2O=Al(OH)3↓+CO![]() ,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2—)>c(OH) |
B | 0.01 | c(CO32—)+c(HCO3—)+c(H2CO3)=c(AlO2—) |
C | 0.015 | c(Na+)>c(CO32—)>c(OH)>c(HCO3—) |
D | 0.03 | c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+c(OH) |
A.AB.BC.CD.D