题目内容
【题目】某硫原子的质量是a g,12C原子的质量是b g,若NA表示阿伏加德罗常数,则下列说法中正确的是
①该硫原子的相对原子质量为12a/b ②m g该硫原子的物质的量为m/aNA mol
③12C原子的摩尔质量是12g或bNA g ④a g该硫原子所含的电子数为16
A.①③④B.②③④C.①②④D.①②③
【答案】C
【解析】
①该硫原子的相对原子质量=![]() =
=![]() ,①项正确;
,①项正确;
②1mol碳原子的个数是NA,n=![]() =
=![]() mol,②项正确;
mol,②项正确;
③摩尔质量的单位为g/mol, ③项错误;
④a g该硫原子的个数=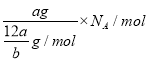 =
=![]() NA,一个硫原子中含有16个电子,所以a g该硫原子所含的电子数为
NA,一个硫原子中含有16个电子,所以a g该硫原子所含的电子数为![]() NA,或者由于该硫原子的质量是a g,故a g该硫原子数目为1个,故含有电子数目为16,④项正确,
NA,或者由于该硫原子的质量是a g,故a g该硫原子数目为1个,故含有电子数目为16,④项正确,
综上所述,①②④符合题意,C项正确,
答案选C。

练习册系列答案
相关题目