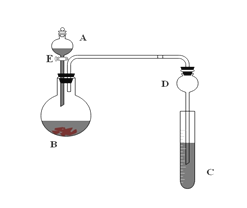
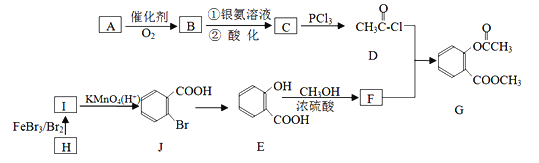
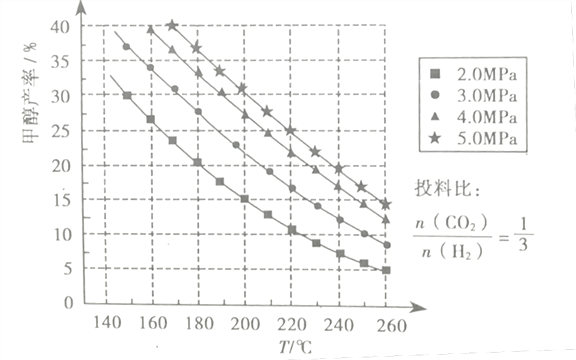
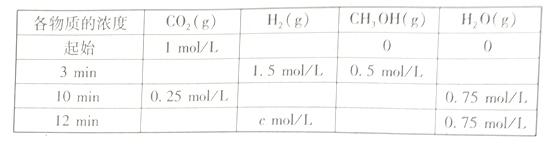题目内容
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
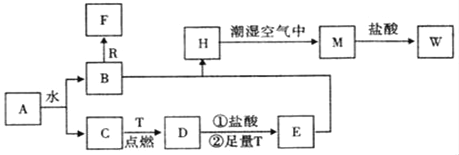
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
【答案】Na2O2 Fe3O4 FeCl3 2Al+2OH﹣+2H2O=2AlO﹣2+3H2↑ 2Na2O2+2CO2=2Na2CO3+O2 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3;
A为淡黄色固体,能与水反应,即A为Na2O2,Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,C为无色无味的气体,即C为O2,B为NaOH,R为常见金属单质,即R为Al,F为无色无味气体,即F为H2,T为两种生活中常见的金属单质,即T为Fe,D为Fe3O4,Fe3O4与盐酸反应生成FeCl2和FeCl3,加入过量的Fe,Fe与FeCl3反应生成FeCl2,即E为FeCl2,H为Fe(OH)2,M为Fe(OH)3,W为FeCl3,
(1)根据上述分析,物质A为Na2O2,D的化学式为Fe3O4,W的化学式为FeCl3;
(2)Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Na2O2与CO2反应的方程式为2Na2O2+2CO2=2Na2CO3+O2;
(4)Fe(OH)2被氧气氧化成Fe(OH)3,其反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】Ⅰ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积KW | 1×10-14 | 1×10-13 | 1×10-12 |
试回答以下问题:
(1)在t2℃下,将amol·L-1CH3COOH溶液与bmol·L-1NaOH客液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH 的电离常数Ka=_______(用a、b 表示)。
(2)25℃时,有pH=4的醋酸溶液和氯化氨溶液,醋酸中水电离高出的H+浓度与氯化氨溶液中水电离出的H+浓度之比是_______。
(3)25℃时,向体积为VamLpH=3的醋酸溶液中滴加pH=11的NaOH溶液VbmL 至溶液恰好呈中性,则Va与的Vb关系是Va_______Vb (填“>”、“<”或“=”)。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不确的是(______)
CH3COO-+H+,下列叙述不确的是(______)
a.CH3COOH 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
b.0.1mol/L的CH3COOH 溶液加水稀释,溶液中c(OH-)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH 溶液等体积混合后溶液的pH<7
e .室温下,向pH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
Ⅱ.某镁盐溶液中含有杂质离子Cr3+,所含主要离子及其浓度如下表所示(H+和OH-未列出):
离子 | Mg2+ | Cr3+ | Cl- |
浓度(mol·L-1) | 0.5 | 0.01 | a |
已知25℃时,KspCr(OH)3=10-32;KspMg(OH)2=5×10-11;操作过程中溶液体积的变化忽略不计。
(5)表格中的a___________1.03(填“<”、“>”或“=”)。
(6)除去杂质Cr3+离子,可加入MgO调节溶液pH, 理论上应调节pH的范围是_______。
(7)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2·6H