题目内容
【题目】甲醇(CH3OH)可作为新型汽车动力燃料,以下是甲醇在工业上的制备过程:

请回答下列问题:
(1)在一定条件下反应室Ⅰ中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
(2)在容积不变的条件下,不能说明反应室Ⅰ中的反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不在改变 b.容器内的压强保持不变
c.CH4的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)在容积为1L反应室Ⅱ中充入1molCO与2molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
(4)氢氧燃料电池的反应原理示意图如图所示。
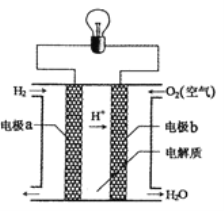
该电池中电极b是_____(填“正极”或“负极”),其电极反应式为______。
【答案】0.003 d 15:7 正 O2+4e-+4H+=2H2O
【解析】
(1)先计算V(CO),然后根据方程式中CO、H2生成关系计算V(H2);
(2)根据可逆反应达到平衡时,任何物质的物质的量、物质的量浓度及物质的量分数等不变分析、判断;
(3)先计算平衡时各种气体的物质的量,然后根据物质的量的比等于压强比计算;
(4)在燃料电池中通入燃料的电极为负极,通入氧气的电极为正极,结合电解质溶液的酸碱性书写反应方程式。
(1)根据化学反应速率V(CO)=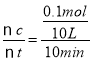 =0.001 mol/(L·min),根据方程式CH4(g)+H2O(g)
=0.001 mol/(L·min),根据方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知:每反应产生1个CO,就会同时产生3个H2,所以V(H2)=3V(CO)=3×0.001 mol/(L·min)=0.003 mol/(L·min);
CO(g)+3H2(g)可知:每反应产生1个CO,就会同时产生3个H2,所以V(H2)=3V(CO)=3×0.001 mol/(L·min)=0.003 mol/(L·min);
(2) a.CO是生成物,若未达到平衡,则CO的物质的量就会发生变化,所以CO的物质的量不再改变,说明反应达到平衡状态,a不符合题意;
b.该反应在恒容密闭容器中进行,反应前后气体的物质的量改变,若容器内的压强保持不变,说明气体的物质的量不变,反应达到平衡状态,b不符合题意;
c.CH4的消耗速率与生成速率相等,则甲烷的物质的量不变,反应处于平衡状态,c不符合题意;
d.反应在恒容密闭容器内进行,反应混合物都是气体,无论反应是否进行,也无论反应是否处于平衡状态,容器内的密度始终保持不变,因此不能根据气体密度不变判断平衡状态,d符合题意;
故合理选项是d;
(3)可逆反应CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
n(开始)mol 1 2 0
n(转化)mol 0.8 1.6 0.8
n(平衡)mol 0.2 0.4 0.8
平衡时气体的总物质的量为n(总)平衡=0.2mol+0.4mol+0.8mol=1.4mol,反应开始时的总物质的量为1mol+2mol=3mol,由于容器的容积不变,所以反应前后的压强比等于气体的物质的量的比,故p(前):p(后)=n(前):n(后)=3:1.4=15:7;
(4)在该燃料电池中,a电极通入H2,为负极,b电极通入O2,为正极,由于电解质溶液为酸性,所以在正极b上发生的反应为O2+4e-+4H+=2H2O;在负极a上,H2失去电子,发生氧化反应,电极反应式为H2-2e-=2H+。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g ) ΔH1=-178 kJ/mol
②2CO(g)+O2(g)2CO2(g) ΔH2=-566 kJ/mol
③2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ/mol
已知反应①中相关的化学键键能数据如下:
化学键 | C—C | C—H | H—H | C—O | H—O |
键能/ kJ/mol | 348 | 413 | 436 | 358 | 463 |
由此计算断开1 mol C![]() O需要吸收____________kJ的能量(甲醇的球棍模型如图所示
O需要吸收____________kJ的能量(甲醇的球棍模型如图所示 );
);
CO(g)+2H2(g)CH3OH(g) ΔH=________ kJ/mol。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如下图所示:通入a气体的电极是原电池的______极(填“正”或“负”),其电极反应式为___________________。

(3)下图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是______(填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____mol,消耗标准状况下CH4________mL。

【题目】下表列出了①~⑤五种元素在周期表中的位置:
ⅠA | O | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ||||||
请回答下列问题:
(1)写出以上五种元素对应的元素符号_______、_______、_______、_______、_______;
(2)②和③元素所形成的气态氢化物的稳定性由强到弱的顺序是(________)
A.前者大 B.后者大 C.相等 D.无法比较
(3)②元素的最高价氧化物的水化物呈(填“酸”、“碱”、“中”)_______性;
(4)②③两种元素的原子半径由大到小的顺序是(用元素符号表示)_______;
A.前者大 B.后者大 C.相等 D.无法比较
(5)①与⑤两种元素形成的化合物的化学式是_______;
(6)②与④两种元素的最高价氧化物的水化物在溶液中相互反应的化学方程式是____;
(7)写出①的氧化物含有的化学键类型_______,写出⑤的原子结构示意图_______;
(8)写出元素③处于第_______周期,第_______族;
(9)写出实验室制取⑤的单质的化学反应方程式_______;实验结束时,尾气处理应选择的试剂是_______溶液(化学式或名称);
(10)周期表中,同一主族从上往下原子半径_______,_______递增;周期表中,同一周期从左向右原子半径_______,_______递增。
【题目】用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项错误的是

甲 | 乙 | 丙 | 试管中的现象 | |
A | 浓硫酸 | 亚硫酸钠 | 石蕊试液 | 先变红后褪色 |
B | 醋酸 | 粉状贝壳 | Na2SiO3溶液 | 浑浊 |
C | 浓氨水 | 生石灰 | AgNO3溶液 | 先沉淀后溶解 |
D | 浓硝酸 | 铜 | 水 | 生成无色气体并在试管口变为红棕色 |
A. A B. B C. C D. D




