题目内容
【题目】下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
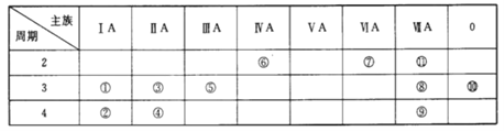
I. (1)化学性质最不活泼的元素是_____(填元素符号,下同),非金属性最强的元素是_____。金属性最强的单质与水反应的离子方程式是________。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是____。
(3)①②③三种元素的原子半径由大到小的顺序是____>____>_____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,该元素为_____。在这两种盐中该元素的化合价为_____,该元素的最高价氧化物和盐酸反应的离子方程式为_______。向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是_______,有关反应的化学方程式为_______。
II.下列物质:①N2②CO2③NH3④Na2O⑤Na2O2⑥ NaOH ⑦CaBr2⑧H2O2 ⑨NH4Cl⑩Ar
(1)既含有极性键又含有非极性键的是_______;(填序号,下同)
(2)含有非极性键的离子化合物是___________
(3)不含化学键的是___________
【答案】Ar F 2K+2H2O=2K++2OH-+H2↑ NaOH K Na Mg Al +3 Al2O3+6H+=2Al3++3H2O 先产生白色沉淀,后沉淀逐渐溶解消失 AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O ⑧ ⑤ ⑩
【解析】
首先将表格中11种元素具体化。依编号顺序,这11种元素依次是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar、F。然后将问题的元素编号一一具体化到某元素,利用元素周期律相关知识进行分析即可。
(1)寻找最活泼的非金属,搜索目标是向上向右,寻找最活泼的金属元素,搜索目标是向左向下;
(2)最高价氧化物水化物的碱性最强,其元素的金属性也最强;
(3)利用同主族和同周期原子半径的变化规律进行比较;
(4)涉及氢氧化铝沉淀的生成和溶解;
(5)分析每一种物质的化学键种类,再挑出所问的3个问题指向的物质编号。
I. (1)化学性质最不活泼的元素是稀有气体元素Ar,非金属性最强的元素是F。金属性最强的单质是K,其与水反应的离子方程式是2K+2H2O=2K++2OH-+H2↑;
(2)①③⑤三种元素分别为Na、Mg、Al,其最高价氧化物对应的水化物分别为NaOH、Mg(OH)2、Al(OH)3中,碱性最强的化合物是NaOH;
(3)①②③三种元素为Na、K、Mg,其原子半径由大到小的顺序是K>Na>Mg;
(4)最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应生成盐和水,该元素为Al。在这两种盐中铝的化合价均为+3价,铝元素的最高价氧化物为Al2O3,其与盐酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O。向AlCl3溶液中,缓慢滴加氢氧化钠溶液至过量,实验现象是:先产生白色沉淀,后沉淀逐渐溶解消失。有关反应的化学方程式为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
II.分析所给物质中含有的化学键可知,N2中只有非极性键,CO2中只有极性共价键,NH3中只有极性共价键,Na2O中只有离子键,Na2O2中既有离子键,又有非极性共价键;NaOH中既有离子键,又有极性共价键;CaBr2中只有离子键,H2O2中既有极性共价键,又有非极性共价键,NH4Cl中既有离子键,又有极性共价键;Ar中没有化学键。所以:
(1)既含有极性键又含有非极性键的是⑧;
(2)含有非极性键的离子化合物是⑤;
(3)不含化学键的是⑩。