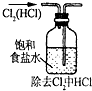
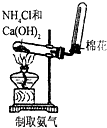
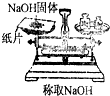
题目内容
18.现有中学常见的A、B、C、D、E、F六种粒子,所含元素的原子序数都不超过18,根据下列条件推断粒子种类,用化学用语回答问题:若A+B+C→白色↓+D(未配平),且A、B、C、D互为等电子粒子,C与D含有两种相同元素,常温下,B为液态,则A为Mg2+或Al3+;写出上述离子方程式或化学方程式:Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+.分析 常温下,B为液态,则B为H2O,A、B、C、D互为等电子粒子,则应含有10个电子,由若A+B+C→白色↓+D(未配平),且所含元素的原子序数都不超过18,可知生成的白色沉淀应为Al(OH)3或Mg(OH)2,C与D含有两种相同元素,C应为NH3,D为NH4+,A为Mg2+或Al3+,以此解答该题.
解答 解:B为液态,应为H2O,A、B、C、D互为等电子粒子,则应含有10个电子,由若A+B+C→白色↓+D(未配平),且所含元素的原子序数都不超过18,可知生成的白色沉淀应为Al(OH)3或Mg(OH)2,C与D含有两种相同元素,C应为NH3,D为NH4+,A为Mg2+或Al3+,反应的离子方程式为Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
故答案为:Mg2+或Al3+;Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+或Al3++3NH3+3H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握物质的性质以及反应特点,难度不大.

练习册系列答案
相关题目
9.下列说法不正确的是( )
| A. | 在化学反应进行的过程中放出或吸收的热量称为反应热 | |
| B. | 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热 | |
| C. | 氢氧化钡晶体与氯化铵晶体混合是吸热反应 | |
| D. | 化学反应中的能量变化与参加反应的物质的量成正比 |
13.核外电子排布相同的离子aAm+和bBn-,两种元素的质子数,前者与后者的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
3.25℃,将Va mL,PH=2的CH3COOH溶液与Vb mL PH=12的NaOH溶液混合,下列说法正确的是( )
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
10.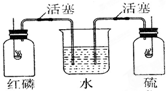 如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
 如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )| A. | 水迅速进入甲瓶和乙瓶 | B. | 水不进入甲瓶和乙瓶 | ||
| C. | 水只能进入甲瓶而不能进入乙瓶 | D. | 水只能进入乙瓶而不能进入甲瓶 |
6.下列实验操作所对应的现象与结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 绪论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液NO3-被Fe2+还原为NO2 |
| B | 溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向含有硫酸钡沉淀的溶液加入浓碳酸钠溶液,充分搅拌后过滤、洗涤,在滤渣中加入盐酸 | 产生无色无味气体 | Ksp(BaSO4)>Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
7.室温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的盐酸与0.2 mol•L-1氨水等体积混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |