题目内容
15.以下试剂不能鉴别H2S和SO2的是( )| A. | NaOH溶液 | B. | 滴有淀粉的碘水 | C. | CuSO4溶液 | D. | 品红溶液 |
分析 H2S和SO2均与碱反应,SO2具有还原性与碘水反应,且具有漂白性;H2S与CuSO4溶液反应生成沉淀,以此来解答.
解答 解:A.二者均与NaOH反应生成可溶性盐和水,现象相同,不能鉴别,故A选;
B.SO2与碘水反应,溶液由蓝色变为无色,而H2S不能,现象不同,可鉴别,故B不选;
C.H2S与CuSO4溶液反应生成沉淀,而SO2不能,现象不同,可鉴别,故C不选;
D.SO2能使品红溶液褪色,而H2S不能,现象不同,可鉴别,故D不选;
故选A.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与实验能力的考查,注意物质特性的应用,题目难度不大.

练习册系列答案
相关题目
6.下列实验操作所对应的现象与结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 绪论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液NO3-被Fe2+还原为NO2 |
| B | 溴乙烷中加入氢氧化钠溶液加热充分反应后,滴入硝酸银溶液 | 产生浅黄色沉淀 | 溴乙烷中含有溴元素 |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向含有硫酸钡沉淀的溶液加入浓碳酸钠溶液,充分搅拌后过滤、洗涤,在滤渣中加入盐酸 | 产生无色无味气体 | Ksp(BaSO4)>Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
3.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( )
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
10.下列有机物的名称与结构简式相符的是( )
| A. | 石炭酸: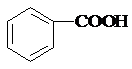 | B. | 甘油: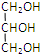 | C. | 蚁酸:CH3COOH | D. | 木精:CH3CH2OH |
20.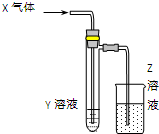 用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )| X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | NO2 | 硫酸亚铁 | H2O | 溶液颜色变黄 |
| B | CO2 | 氯化钡溶液 | Ca(OH)2 | 白色沉淀 |
| C | Cl2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B、 | C. | C | D. | D |
7.室温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的盐酸与0.2 mol•L-1氨水等体积混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |
5.化学与生产、生活密切相关.下列说法的是( )
| A. | 小苏打是发酵粉的主要成分 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 向汽油中添加乙醇后,该混合燃料的热值不变 | |
| D. | 粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
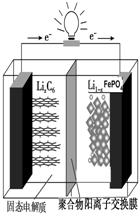 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4