题目内容
4.孔雀石主要含Cu2(OH)2CO3,还含少量FeO、SiO2.以孔雀石为原料可制备CuSO4•5H2O步骤如下: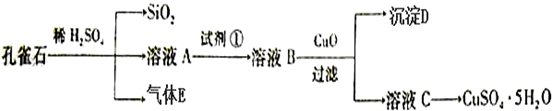
(1)写出孔雀石与稀硫酸反应的化学方程式:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,
为了提高原料浸出速率,可采取的措施有增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等(写出两条).
(2).溶液A的金属离子有Cu2+、Fe2+.实验步骤中试剂①最佳选c(填代号).
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是调pH值,(或减少c(H+),)使Fe3+沉淀完全.
(4)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10-3mol/L,必需将溶液pH调节至2.
(5)由溶液C获得CuSO4•5H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液)、冷却结晶和过滤.
(6)可用KMnO4标准溶液测定溶液A中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO410.00ml,A溶液中Fe2+的物质的量浓度0.025mol/L.(反应原理:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)
分析 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,Fe+H2SO4=FeSO4+H2↑,硅和稀硫酸不反应,溶液A只含Cu2+、Fe2+两种金属离子,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2、H2,向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,可选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为Fe(OH)3,以及过量的试剂,溶液C为硫酸铜溶液,所以为试剂②为CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3,据此答题.
(1)碱式碳酸铜为碱式盐能与稀硫酸反应,依据影响化学反应速率的因素分析判断;
(2)双氧水是一种绿色试剂,将Fe2+氧化为Fe3+,但无明显现象;
(3)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,且不引入新的杂质;
(4)依据溶度积常数计算氢氧根离子浓度,结合离子积常数计算氢离子浓度得到溶液PH;
(5)溶液中得到溶质的方法是经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,得到溶质;
(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4-被还原为Mn2+,最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,结合原子守恒和电荷守恒配平写出离子方程式,结合定量关系计算亚铁离子浓度.
解答 解:孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,Fe+H2SO4=FeSO4+H2↑,硅和稀硫酸不反应,溶液A只含Cu2+、Fe2+两种金属离子,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2、H2,向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,可选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为Fe(OH)3,以及过量的试剂,溶液C为硫酸铜溶液,所以为试剂②为CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3,
(1)碱式碳酸铜为碱式盐能与稀硫酸反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,生成硫酸铜、水和二氧化碳,为了提高原料浸出速率,可采取的措施有增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等;
(2)Fe2+具有还原性,可被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,与KSCN不反应,加入氢氧化钠溶液可生成氢氧化铁、氢氧化铜沉淀而不能检验Fe2+,双氧水,双氧水是一种绿色试剂,将Fe2+氧化为Fe3+,但无明显现象,只有c正确,
故答案为:c;
(3)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,且不引入新的杂质,
故答案为:调pH值,(或减少c(H+),)使Fe3+沉淀完全;
(4)常温下Fe(OH)3的Ksp=1×10-39,使溶液中c(Fe3+)=1×10-3mol/L,则c(OH-)=$\root{3}{\frac{1×10{\;}^{-39}}{1×10{\;}^{-3}}}$mol/L=1×10-12mol/L,所以溶液中c(H+)=1×10-2mol/L,则pH=2,
故答案为:2;
(5)CuSO4•5H2O晶体,在高温时易失去水,所以从溶液中获得CuSO4•5H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,
故答案为:蒸发浓缩(或加热蒸发、蒸发溶液)、冷却结晶;
(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4-被还原为Mn2+,最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4-~5Fe2+,用去 KMnO4的物质的量为10.00mL×0.010mol/L=1.0×10-4mol,所以A溶液中Fe2+浓度为$\frac{1.0×10{\;}^{-4}mol×5}{0.02L}$=0.025mol/L,
故答案为:0.025.
点评 本题考查以孔雀石为主要原料制备CuSO4•5H2O及纳米材料,为高频考点和常见题型,侧重于学生的分析、实验和计算能力得到考查,注意把握实验的原理以及物质的性质,为解答该类题目的关键,注意掌握实验基本操作和流程分析,题目难度中等.

| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
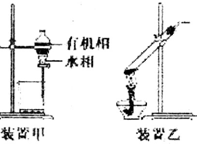
| A. | 容量瓶、分液漏斗和滴定管都需要验漏 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 配制500mL0.1mol•L?1NaCl溶液用到的玻璃仪器只有500mL容量瓶、烧杯和玻璃棒 |
| A. | 0.12mol | B. | 0.2mol | C. | 0.4mol | D. | 0.8mol |
| A. | 常温下,23g NO2和N2O4的混合气体含有NA个氧原子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
| A. | 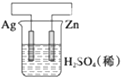 负极反应式为2H++2e-═H2↑ | B. | 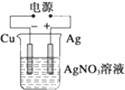 阳极反应式为Ag++e-═Ag | ||
| C. | 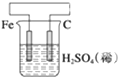 H+向碳棒方向移动 | D. |  电解开始时阳极产生黄绿色气体 |
| A. | 加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体 | |
| C. | 某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42- | |
| D. | 未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32- |
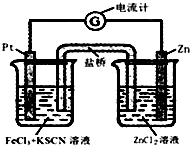 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
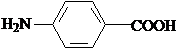 ;B的结构简式是
;B的结构简式是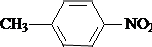 .
.