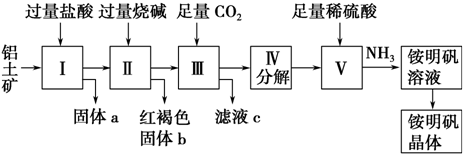
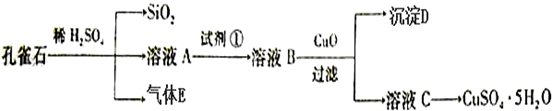
题目内容
14.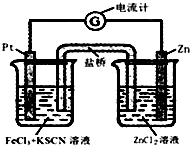 298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )
298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+.据此某学习小组设计如图所示的原电池装置.下列有关说法正确的是( )| A. | 正极反应为:Zn-2e-→Zn2+ | B. | 盐桥中K+向右池移动 | ||
| C. | Pt电极上有气泡出现 | D. | 左烧杯中溶液的红色变浅 |
分析 Zn失去电子发生氧化反应,为负极,Zn-2e-→Zn2+,Fe3+在正极得电子被还原为Fe2+,Fe3++e-=Fe2+,该电池总反应为:Zn+2Fe3+═2Fe2++Zn2+,以此解答.
解答 解:A.Zn失去电子发生氧化反应,为负极反应,Fe3+在正极得电子被还原为Fe2+,故A错误;
B.原电池中,电解质里的阳离子移向正极,盐桥中K+向左池移动,故C错误.
C.铂电极上Fe3+被还原为Fe2+,没有气体生成,故C错误;
D.Fe3+在正极得电子被还原为Fe2+,溶液红色变浅甚至褪去,故D正确;
故选D.
点评 本题考查原电池知识,侧重于原电池的设计,注意把握电解方程式的书写以及原电池的工作原理,难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
2.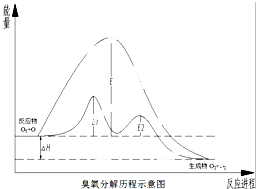 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )
总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |
9.下列有关实验的叙述正确的是( )
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验需要480mL 2.0mol•L-1的氢氧化钠溶液.配制该溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| D. | 用溴水,淀粉、KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
6.氢氧化钠不能用玻璃塞保存是因为玻璃中含有( )
| A. | Si | B. | SiO2 | C. | H2SiO3 | D. | Na2SiO3 |
3.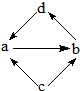 下列各组物质中,物质之间通过一步反应就能实现图所示转化的是
下列各组物质中,物质之间通过一步反应就能实现图所示转化的是
( )
 下列各组物质中,物质之间通过一步反应就能实现图所示转化的是
下列各组物质中,物质之间通过一步反应就能实现图所示转化的是| 编号 | a | b | c | d |
| ① | Na2O | Na2O2 | Na | NaOH |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| ③ | FeCl2 | FeC13 | Fe | CuCl2 |
| ④ | NO | NO2 | N2 | HNO3 |
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ①③④ |
4.电镀等工业废水中常含有剧毒、致癌的Cr2O72-.该废水处理的一种方法是:利用还原剂把Cr2O72-还原成毒性较低的Cr3+,再加碱生成沉淀.另一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解.下列说法错误的是( )
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
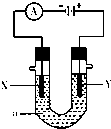 如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: