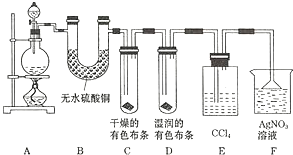
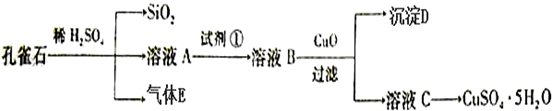
题目内容
12.足量的铜放入400mL浓度为2mol•L-1的硝酸中,还原产物在空气中变成红褐色,充分反应后,被还原的HNO3的物质的量为( )| A. | 0.12mol | B. | 0.2mol | C. | 0.4mol | D. | 0.8mol |
分析 足量的铜与硝酸反应,反应后溶液中的溶质是硝酸铜,根据化学反应方程式计算被还原的硝酸的物质的量.
解答 解:铜与稀硝酸发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,被还原的HNO3的物质的量是参加反应的硝酸的物质的量是0.25倍,参加反应的硝酸是0.4mol×2mol/L=0.8mol,所以还原的HNO3的物质的量是0.8mol×0.25=0.2mol.
故选B.
点评 考查氧化还原反应的计算,难度中等,注意根据方程式得到:还原的HNO3的物质的量是参加反应的硝酸的物质的量是0.25倍,再进行计算是关键.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
3.下列离子能大量共存,且满足相应条件的是( )
| 选项 | 离子组 | 条件 |
| A | K+、Na+、Cu2+、Cl- | 溶液呈无色 |
| B | Na+、Fe3+、NO3-、SO42- | 滴入酸性KMnO4溶液,溶液褪色 |
| C | Al3+、SO42-、Cl-、H+ | 加入氨水产生白色沉淀后沉淀溶解 |
| D | Na+、NO3-、I-、SO42- | 加入盐酸和淀粉溶液变蓝 |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法不正确的是( )
| A. | SiO2可与HF反应,因而氢氟酸不能保存在玻璃瓶中 | |
| B. | SiO2可与水反应生成H2SiO3 | |
| C. | 向氯水中加CaCO3粉末,可提高溶液中HClO的浓度 | |
| D. | 向氯水中滴加蓝色石蕊试液先变红后褪色 |
7.下表是元素周期表的一部分,针对表中的 种元素回答下列有关问题:
(1)在这些元素中,最活泼金属元素的原子结构示意图为 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
(2)②、③、⑤、⑥、⑦形成的气态氢化物中最稳定的是HF(填化学式).
(3)④与②组成的某种化合物和①与②组成的某种化合物反应生成氧气,写出这两种化合物的电子式 ,
,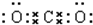 .
.
(4)用电子式表示元素④与⑥构成化合物的形成过程: 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.
(5)能说明④与⑧金属性强弱的事实是分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱(举一例)
(6)设计实验方案比较⑥与⑦非金属性强弱
Cl2、S分别与H2反应
硫化钠和氯气反应.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).(2)②、③、⑤、⑥、⑦形成的气态氢化物中最稳定的是HF(填化学式).
(3)④与②组成的某种化合物和①与②组成的某种化合物反应生成氧气,写出这两种化合物的电子式
 ,
,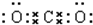 .
.(4)用电子式表示元素④与⑥构成化合物的形成过程:
 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.(5)能说明④与⑧金属性强弱的事实是分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱(举一例)
(6)设计实验方案比较⑥与⑦非金属性强弱
Cl2、S分别与H2反应
硫化钠和氯气反应.
1.NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 氢氧燃料电池正极消耗 22.4 L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 | |
| D. | 10LpH=13的NaOH溶液中含有的OH-离子数为2NA |
2.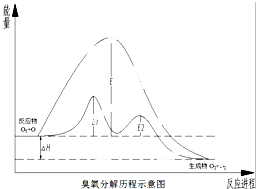 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )
总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )总反应:O3+O→2O2
催化反应:①O3+Cl→O2+ClO;②ClO+O→Cl+O2.
| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |