题目内容
18.在HF、H2O、NH3、CH4、N2、CO2、HI分子中:(1)以非极性键结合的非极性分子是N2.
(2)以极性键相结合,具有正四面体结构的非极性分子是CH4.
(3)以极性键相结合,具有三角锥型结构的极性分子是NH3.
(4)以极性键相结合,具有v型结构的极性分子是H2O.
(5)以极性键相结合,而且分子极性最大的是HF.
分析 由不同非金属元素形成的化学键为极性键;由同种非金属元素形成的化学键为非极性键;只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子;极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答 解:HF中含有极性键,正负电荷的中心不重合,属于极性分子,分子极性最大;
H2O中含有极性键,空间结构为折线型,属于极性分子;
NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,属于极性分子;
CH4中含有极性键,空间结构为正四面体,正负电荷的中心重合,属于非极性分子;
N2中只含非极性键,属于非极性分子;
CO2含有极性键,空间结构为直线型,属于非极性分子;
HI中含有极性键,正负电荷的中心不重合,属于极性分子;
故答案为:N2;CH4;NH3;H2O;HF.
点评 本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
9.能正确表示下列化学反应的离子方程式是( )
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
13.下列关于 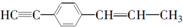 的说法中正确的是( )
的说法中正确的是( )
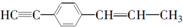 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
3.下列化学用语的书写正确的是( )
| A. | 二氧化硅晶体的分子式:SiO2 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | F-离子结构示意图: | D. | 四氯化碳的电子式: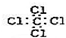 |
10.下列各组离子,能在溶液中大量共存的是( )
| A. | NH4+、Na+、OH-、SO42- | B. | NH4+、Mg2+、NO3-、Cl- | ||
| C. | Ba2+、OH-、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
7.铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图甲,已知:部分物质沉淀的pH如表:

CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O
(4)当离子浓度≤1×10-5mol•L-1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.(已知Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O
(4)当离子浓度≤1×10-5mol•L-1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.(已知Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
 ,
, .
.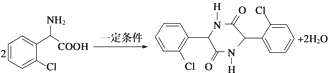 .
.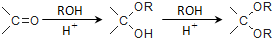 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应
的最后一步反应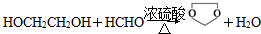 .
.
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.