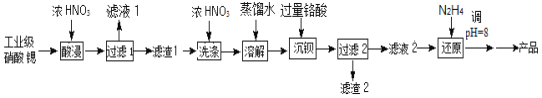
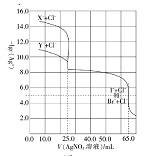
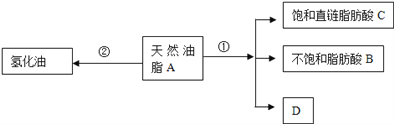
题目内容
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
I.CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H1=akJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)的△H=__kJ/mol。
Ⅱ.某温度下,在容积为2L的密闭容器中投入8molCO2(g)、16molH2(g)发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
CO(g)+H2O(g),15min后达到平衡,此时CO2的转化率为75%。则
①0~15min内用二氧化碳表示平均反应速率v(CO2)=__,
②计算此条件下该反应的平衡常数K=__。
Ⅲ.捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中能作为CO2捕获剂的是__。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(1)+CO2(g)![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充人一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
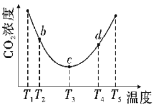
b、c、d三点的平衡常数Kb、Kc、Kd从大到小的顺序为__。
【答案】![]() 0.2mol/(L·min) 1.8 AB Kb>Kc>Kd
0.2mol/(L·min) 1.8 AB Kb>Kc>Kd
【解析】
I.CO可用于高炉炼铁,已知:①Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol,则1/3[①![]() +②]得反应;
+②]得反应;
II.设反应的CO2为Xmol,
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L)4 8 0 0
变化量(mol/L)X X X X
平衡量(mol/L)4-X 8-X X X
由15min后达到平衡时CO2的转化率为75%,所以![]() =75%,所以X=3mol/L,再利用公式可求v(CO2),平衡常数K;
=75%,所以X=3mol/L,再利用公式可求v(CO2),平衡常数K;
III.(1)根据捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。A.Na2CO3、B.NaOH均能和CO2反应,可以用作工业捕碳剂,而C.CH3CH2OH、D.NH4Cl均不能和CO2反应,故不可以用作工业捕碳剂;
(2)根据图像该化学反应随温度的升高,平衡逆向移动,所以该反应是放热反应,b、c、d三点温度逐渐升高,所以b、c、d三点的平衡常数K b >K c>Kd。
I.CO可用于高炉炼铁,已知:①Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol,则1/3[①![]() +②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=
+②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= ![]() kJ/mol,故答案为:
kJ/mol,故答案为:![]() ;
;
II.①设反应的CO2为Xmol,
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L)4 8 0 0
变化量(mol/L)X X X X
平衡量(mol/L)4-X 8-X X X
由15min后达到平衡时CO2的转化率为75%,所以![]() =75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L
=75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L![]() 15min= 0.2mol/(L·min),故答案为:0.2mol/(L·min);
15min= 0.2mol/(L·min),故答案为:0.2mol/(L·min);
②上述条件下反应的平衡常数K=32![]() (1
(1![]() 5)=1.8,故答案为:1.8;
5)=1.8,故答案为:1.8;
III. (1) 根据捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。A. Na2CO3、B. NaOH均能和CO2span>反应,可以用作工业捕碳剂,而C. CH3CH2OH、D. NH4Cl均不能和CO2反应,故可以用作工业捕碳剂。所以答案:AB;
(2)根据图像该化学反应随温度的升高,平衡逆向移动,所以该反应是放热反应,b、c、d三点温度逐渐升高,所以b、c、d三点的平衡常数K b >K c>Kd,所以答案:K b >K c>Kd。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案