��Ŀ����
����Ŀ����þԭ�Ӻ�����____�ֲ�ͬ�˶�״̬�ĵ��ӣ�____�ֲ�ͬ����״̬�ĵ��ӣ�
��A��B��C��D��E����5��Ԫ�ء�����գ�
��1��AԪ�ػ�̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӣ���Ԫ�ط���Ϊ_____
��2��BԪ�صĸ�һ�����ӵĵ��Ӳ�ṹ�����ͬ��B��ԭ�ӽṹʾ��ͼΪ_____
��3��CԪ���ǵ�����������δ�ɶԵ��ӵ�����Ԫ�أ����ĵ����Ų�ͼΪ_____
��4��DԪ�ػ�̬ԭ�ӵ�M��ȫ������N����һ�����ӣ�D��̬ԭ�ӵĵ����Ų�ʽΪ_____
��5��Eԭ�ӹ���3���۵��ӣ�����һ���۵���λ�ڵ����ܲ�d�����ָ����Ԫ�������ڱ�����������������������_____
�磮�÷��š�������������=���������и����ϵ��
��1����һ�����ܣ�N_____O��Mg_____Ca��
��2���縺�ԣ�O_____F��N_____P��
��3�������ߵͣ�ns_____np��4s_____3d��
���𰸡� 12 4 N 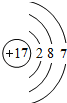
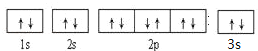 1s22s22p63s23p63d104s1��[Ar]3d104s1 �������ڡ�IIIB�� �� �� �� �� �� ��
1s22s22p63s23p63d104s1��[Ar]3d104s1 �������ڡ�IIIB�� �� �� �� �� �� ��
����������������һ������þ�ĺ�������Ų�ʽ���
����������ԭ�ӻ����ӵĺ�������Ų�ȷ��Ԫ�ص�����������ȷ��Ԫ�ص����࣬���������
���������ݵ�һ�����ܡ��縺�Եı仯�����Լ�����ԭ�����
��⣺��һ��Mg��ԭ��������12����������Ų�ʽΪ1s22s22p63s2����þԭ�Ӻ�����12�֣�
��������1����̬ԭ�ӵ��������3��δ�ɶԵ��ӣ��������2�����ӵ�Ԫ���ǵ�Ԫ�أ�Ԫ�ط���ΪN��
��2��B-�ĵ��Ӳ�ṹ�����ͬ��BΪClԪ�أ���ṹʾ��ͼΪ ��
��
��3��CԪ���ǵ�����������δ�ɶԵ��ӵ�����Ԫ�أ�C��Mg��Mg���еĺ��������Ϊ12������������Ų�ʽΪ1s22s22p63s2�������Ų�ͼΪ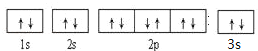 ��
��
��4��DԪ�ػ�̬ԭ�ӵ�M��ȫ������N��ֻ��һ��δ�ɶԵ��ӣ�ӦΪCuԪ�أ�������Ų�ʽΪ1s22s22p63s23p63d104s1��[Ar]3d104s1��
��5��EԪ��ԭ�ӹ���3���۵��ӣ�����һ���۵���λ�ڵ����ܲ�d������۵����Ų�ʽΪ3d14s2������ǰ��ĵõ���������Ų�ʽ1s22s22p63s23p63d14s2������ܲ���Ϊ4��˵��λ�ڵ������ڣ��۵����Ų�ʽΪ3d14s2��˵��λ�ڵڢ�B�壻
��������1���ǽ�����Խǿ����һ������Խ�����ڰ������ȫ������״̬��һ�����ܴ�������Ԫ�أ����һ�����ܣ�N��O��Mg��Ca��
��2���ǽ�����Խǿ���縺��Խ����縺�ԣ�O��F��N��P��
��3�����ݹ���ԭ����֪�����ߵͣ�ns��np��4s��3d��

 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[��NH4��2S2O8]��ͬʱ����TiO��OH��2�ļ�Ҫ�������£�
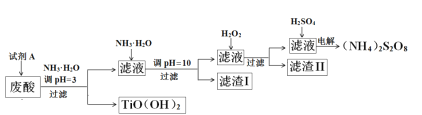
��֪��i.����������ȫ�����������������pH
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe��II����������[Fe��NH3��2]2+��
��ش��������⣺
��1��Ϊ��֤����TiO(OH)2�Ĵ��ȣ������Լ�AҪ�������Լ�AΪ___________��
��2�����ջ��յ�TiO��OH��2����õ�TiO2�ᷢ�ƣ����Ƶ����ʿ�����_______���ѧʽ����
��3������I����Ҫ�ɷֳ�Fe(OH)2��Al��OH��3�⣬������______________��
��4������H2O2��Ŀ������������Fe��II����������[Fe��NH3��2]2+����ƽ�������ӷ���ʽ��2[Fe��NH3��2]2+ +________+4H2O +H2O2 =_______ + 4NH3��H2O
��5������Ʊ���������淋�װ������ͼ��ʾ��
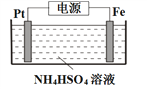
��S2O82-��SԪ�صĻ��ϼ�Ϊ+6�����й���������ĿΪ___________��
�ڵ��ʱ�����缫���ӵ�Դ��___________����
�۳����£����Һ�к�������Ҫ������ʽ�� pH �Ĺ�ϵ����ͼ��ʾ��
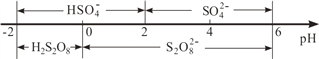
�������ŵ��������ҪΪHSO4-���������������Һ�� pH ��ΧΪ______�������ĵ缫��ӦʽΪ______________________��