题目内容
【题目】下列实验设计及其对应的离子方程式均正确的是
A. 用FeCl3溶液腐蚀铜箔制作印刷电路板:Fe3++Cu=Cu2++Fe3+
B. 用Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4![]() CaCO3+SO42-
CaCO3+SO42-
C. 碳酸钠溶液显碱性:CO32-+2H2O=HCO3-+2OH-
D. 用NaOH溶液吸收氯气:Cl2+2OH-=2Cl-+H2O
【答案】B
【解析】分析:A.根据电荷守恒判断,该离子方程式两边正电荷不守恒;B.碳酸钙溶解性小于硫酸钙,硫酸钙沉淀转化成更难溶的碳酸钙沉淀;C.碳酸钠溶液中,碳酸根离子水解,溶液显示碱性,碳酸根离子的水解分步进行;D.氢氧化钠溶液与氯气反应生成氯化钠、次氯酸钠和水。
详解:A.用FeCl3溶液腐蚀铜箔制作印刷电路板,铁离子与铜反应生成铜离子和亚铁离子,离子方程式必须遵循电荷守恒,正确的离子方程式为:2Fe3++Cu═Cu2++2Fe2+,故A错误;B.用Na2CO3溶液处理水垢中的CaSO4,微溶物硫酸钙转化成更难溶的碳酸钙沉淀,反应的离子方程式为:CO32-+CaSO4![]() CaCO3+SO42-,故B正确;C.碳酸钠溶液显碱性,碳酸根离子的水解分步进行,离子方程式中应该分步写,主要写出第一步即可,正确的水解方程式为:CO32-+H2O═HCO3-+OH-,故C错误;D.NaOH溶液吸收氯气,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,故D错误;故选B。
CaCO3+SO42-,故B正确;C.碳酸钠溶液显碱性,碳酸根离子的水解分步进行,离子方程式中应该分步写,主要写出第一步即可,正确的水解方程式为:CO32-+H2O═HCO3-+OH-,故C错误;D.NaOH溶液吸收氯气,反应生成氯化钠、次氯酸钠和水,正确的离子方程式为:Cl2+2OH-═ClO-+Cl-+H2O,故D错误;故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
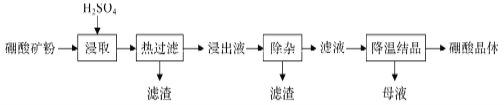
小学生10分钟应用题系列答案【题目】以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、A12O3)为原料生产硼酸的工艺流程如下:
已知:表一:不同温度下H3BO3的溶解度
温度℃) | 20 | 40 | 60 | 100 |
溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
表二:不同物质沉淀完全时的pH
物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施为_________________________。
(2)“浸出液”显酸性,含有H3BO3、Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时,向浸出液中依次加入适量H2O2和MgO,可以除去的杂质离子为_______________________,H2O2的作用为_____________________(用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的为__________________________。
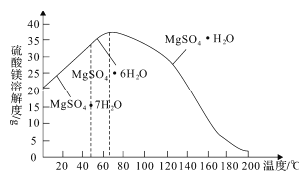
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图所示,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩,____________________________________。
(5)己知25℃时,硼酸(H3BO3)溶液中存在如下平衡:H3BO3![]() [B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
[B(OH)4]-(aq)+H+(aq);K=5.7×10-10;25℃时,0.7mol·L-1硼酸溶液中c(H+)=__________mol·L-1。
(6)已知25℃时:
化学式 | H2CO3 | CH3COOH |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是________(填选项字母)。
a.碳酸钠溶液滴入硼酸溶液中能观察到有气泡产生
b.碳酸钠溶液滴入醋酸溶液中能观察到有气泡产生
c.等浓度碳酸溶液和硼酸溶液的pH:前者>后者
d.等浓度碳酸钠溶液和醋酸钠溶液的pH:前者>后者




