��Ŀ����
����Ŀ���״���CH3OH��������Ϊ��ɫҺ�壬��Ӧ�ù㷺�Ļ���ԭ�Ϻ�ǰ���ֹ۵�ȼ�ϡ�
��1���ټ�֪��CO��H2��CH3OH��ȼ���ȣ���H���ֱ�Ϊ��283.0 kJmol-1����285.8 kJmol-1��-726.8 kJmol-1����CO��H2��Ӧ����CH3OH���Ȼ�ѧ����ʽ��________________��
�����������ۺ�����̫���ܽ���Ȼ��ת��Ϊ���״��˵ļ״���װ������ͼ��װ�ù���ʱ������Ӧ����ʽΪ_________________________________��

��2��һ���¶��·�ӦCO(g)+2H2(g)=CH3OH(g)���ݻ�Ϊ2L���ܱ������н��У���������ݼ���ͼ��
�ٴӷ�Ӧ��ʼ��ƽ��ʱ����H2��ʾ��ѧ��Ӧ����Ϊ__________�����¶��´˷�Ӧ��ƽ�ⳣ��Ϊ__________��
��5min�����ʱ仯�Ӿ��ԭ�������___________________________��
��3����6.98MPa��250��ʹ���(CoI2)�����£��״���ת��Ϊ���
CH3OH(g) + CO(g) = CH3COOH(g)
�л��ϳɳ��и���Ӧ���ڡ�����Ӧ����CH3OH��CO���ϱ�(����)Ϊ1,�״����������ѡ����Ϊ90.0%����˷�ӦCO��ת����Ϊ___________��
��4������Ka(CH3COOH)=1.8��10-5�� 0.1 molL-1CH3COOH��Һ�еμ�0.1 molL-1CH3COONa��Һ�� pH=7����ʱ�����Һ�������ʵ����ʵ�����n(CH3COOH):n(CH3COONa)=___��
���𰸡� CO(g)+2H2(g)=CH3OH(l) ��H = -127.8kJmol-1 CH4 + H2O -2e- = CH3OH + 2H+ 0.06molL-1min-1 ![]() L2mol-2����9.375 L2mol-2�ȡ���λ���۷֣� ʹ�ô��� 78.8%(79%��78.75% 1:180
L2mol-2����9.375 L2mol-2�ȡ���λ���۷֣� ʹ�ô��� 78.8%(79%��78.75% 1:180
����������1������CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJmol-1 ��-726.8kJmol-1 �����CO��g��+1/2O2��g��=CO2��g����H=-283.0kJmol-1 ��CH3OH��l��+3/2O2��g��=CO2��g��+2 H2O��l����H=-726.8kJmol-1 ��H2��g��+1/2O2��g��=H2O��l����H=-286kJmol-1 �ɸ�˹���ɿ�֪�â�+��-2/3���ڵ÷�ӦCO��g��+2H2��g��=CH3OH��l�����÷�Ӧ�ķ�Ӧ�ȡ�H=-283.0kJmol-1 +��-286kJmol-1 ��-2/3��-726.8kJmol-1 ��=-127.8kJmol-1 ����CO��g��+2H2��g��=CH3OH��l����H=-129kJmol-1 ���ʴ�Ϊ��CO��g��+2H2��g��=CH3OH��l����H=-127.8kJmol-1 ��
������̫���ܽ���Ȼ��ת��Ϊ���״��˵ļ״�������ʧȥ���ӣ�����������Ӧ����Ӧ����ʽΪ�� CH4 + H2O -2e- = CH3OH + 2H+ ����2���ٴӷ�Ӧ��ʼ��ƽ��ʱ����H2��ʾ��ѧ��Ӧ����Ϊ![]() =0.06molL-1min-1��K=
=0.06molL-1min-1��K=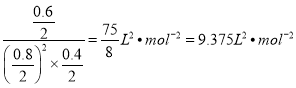
��5min�����ʱ仯�Ӿ��ԭ�������ʹ�ô�������3��CH3OH��CO���ϱ�(����)Ϊ1����Ͷ��1g����Ӧ��COΪ�� ![]() ����CO��ת����Ϊ0.7875g/1g��100%=78.8%(79%��78.75% )����4��
����CO��ת����Ϊ0.7875g/1g��100%=78.8%(79%��78.75% )����4��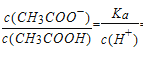
![]() ��n(CH3COOH):n(CH3COONa)=1:180
��n(CH3COOH):n(CH3COONa)=1:180