题目内容
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下2H2O(g) ![]() 2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
(2)乙醇水蒸气重整制氢
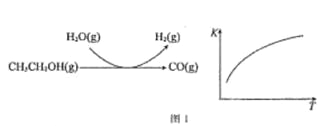
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图 1 所示。某温度下,图 1 所示反应每生成1mol H2(g),热量变化是 62 kJ,则该反应的热化学方程式为________________
(3)水煤气法制氢
CO(g)+ H2O(g) ![]() CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
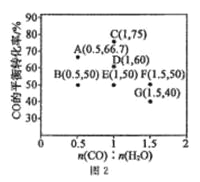
①向 2 L 恒温恒容密闭容器中加入一定量的 CO 和 0.1mol H2O(g),在图中 G 点对应温度下,反应经5 min 达到平衡,则平均反应速率 v(CO)=___________。
②图中 B、E 两点对应的反应温度分别为 TB 和 TE,则 TB ___________TE (填“>”“ <”或“=”)。
③经分析,A、E、G 三点对应的反应温度都相同(均为 T℃),其原因是 A、E、G 三点对应的 _______相同。
④当 T℃时,若向一容积可变的密闭容器中同时充入 3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2 和xmol H2,使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(4)光电化学分解制氢

反应原理如图3,钛酸锶光电极的电极反应式为 4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为 ________。
(5)Mg,Cu 是一种储氢合金
350℃时,Mg、Cu 与 H2 反应,生成 MgCu2 和仅含一种金属元素的氢化物(其中氢的质量分数约为 7.7%)。该反应的化学方程式为_______________。
【答案】![]() CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g) ![]() 4H2(g)+2CO(g) △H=+248kJ/mol0.006mol·L-l·min-1>化学平衡常数(或 K)0≤x<3(或 x<3 )2H2O+2e-=H2↑+2OH-(或2H+ +2e-=H2↑)2Mg2Cu + 3H2=MgCu2 + 3MgH2
4H2(g)+2CO(g) △H=+248kJ/mol0.006mol·L-l·min-1>化学平衡常数(或 K)0≤x<3(或 x<3 )2H2O+2e-=H2↑+2OH-(或2H+ +2e-=H2↑)2Mg2Cu + 3H2=MgCu2 + 3MgH2
【解析】
(1)反应为:2H2O(g)2H2(g)+O2(g),则该反应的平衡常数表达式为K=![]() ,故答案为:
,故答案为:![]() ;
;
(2)温度升高,化学平衡常数值增大,说明温度升高有利于反应正向移动,正反应为吸热反应,根据反应图,发生的化学反应为:CH3CH2OH(g)+H2O(g)4H2(g)+2CO(g),每生成1molH2(g),热量变化是62kJ,则该反应的焓变为△H=+62×4kJ/mol=+248kJ/mol,
故答案为:CH3CH2OH(g)+H2O(g)4H2(g)+2CO(g)△H=+248kJ/mol;
(3)①G点时,原料进气比为1.5:1,加入0.1molH2O(g),则加入n(CO)=0.15mol,平衡转化率为40%,所以v(CO)=![]() =
=![]() =
=![]() =0.006mol/(Lmin),故答案为:0.006mol/(Lmin);
=0.006mol/(Lmin),故答案为:0.006mol/(Lmin);
②反应为放热反应,降低温度有利于反应正向进行,B点的起始投料比低于E点的起始投料比,但B点和E点的平衡转化率相等,增大其中一种反应物的量,自身转化率降低,因为通过降温升高转化率,所以B点和E点的温度关系为TB>TE,故答案为:>;
③温度不变,化学平衡常数值不变,化学平衡常数值只与温度有关,所以A、E、G三点的K值相等,故答案为:K;
④E点原料进气比为1:1,加入amolH2O(g)和amolCO(g),平衡转化率为50%,所以化学平衡常数为K=![]() =
=![]() =
=![]() =1,T℃时,若向一容积可变的密闭容器中同时充入3.0molCO、1.0molH2O(g)、1.0molCO2和xmolH2,为使上述反应开始时向正反应方向进行,则需满足Qc=
=1,T℃时,若向一容积可变的密闭容器中同时充入3.0molCO、1.0molH2O(g)、1.0molCO2和xmolH2,为使上述反应开始时向正反应方向进行,则需满足Qc=![]() =
=![]() <K=1,所以0≤x<3,故答案为:0≤x<3;
<K=1,所以0≤x<3,故答案为:0≤x<3;
(4)根据原电池装置分析,电子由钛酸锶电极流出,钛酸锶电极作为原电池负极,则铂电极为原电池正极,H2O转化为H2和OH-,所以电极反应式为:2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
(5)Mg、Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%),则该金属氢化物应为MgH2,则反应的化学方程式为:2Mg2Cu+3H2=MgCu2+3MgH2,故答案为:2Mg2Cu+3H2=MgCu2+3MgH2。


