题目内容
7. 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:(1)若两个电极分别是Zn、Cu,电解质溶液是稀硫酸,正极的电极反应式为2H++2e-=H2↑;如果把电解质溶液换成硫酸铜溶液,则正极的电极反应式为Cu2++2e-=Cu.
(2)若电解质溶液是稀NaOH溶液,Mg、Al两金属做电极,则Mg是正极(填“正极”或“负极”),总反应的离子方程式是2Al+2H2O+2OH-=2AlO2-+3H2↑.
分析 (1)铜锌原电池中,活泼金属作负极,在正极上有气体生成;若电解质为硫酸铜溶液,则在正极上析出铜;
(2)Mg、Al两种金属做电极,若电解质溶液为稀氢氧化钠溶液,Al失电子是负极.
解答 解:(1)将Zn棒和Cu棒用导线连接后,若电解质溶液为稀硫酸,则锌为负极,铜为正极,负极反应为Zn-2e-=Zn2+,正极反应为:2H++2e-=H2↑,在正极上有气体生成;将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则在正极上析出铜,锌为负极,负极反应为Zn-2e-=Zn2+,正极反应为Cu2++2e-=Cu,
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(2)Mg、Al两种金属做电极,若电解质溶液为氢氧化钠溶液,Al失电子是负极,Mg为正极,正反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:正极;2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评 本题考查原电池的设计及原电池的工作原理、电极反应式书写,题目难度不大,利用基础知识可以解答.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.22gCO2跟多少g水的分子数相等( )
| A. | 9g | B. | 18g | C. | 22g | D. | 44g |
15.下列物质性质的递变关系正确的是( )
| A. | 酸性强弱:HClO3>H2SO3>H3PO4 | B. | 碱性:NaOH>KOH>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性HCl>H2S>PH3 | D. | 氧化性Na+>Mg2+>Al3+ |
2.短周期元素X、Y、Z、W的原子序数依次增大.X的原子半径比Y的小,且X与Y的最外层电子数之和等于Z的最外层电子数.X与W同主族,Z是地壳中含量最高的元素.下列说法不正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | X、Y两种元素可形成分别含有10e-和18e-的化合物 |
19.已知2NO2 (棕红色)═N2O4(无色).在某支针简中抽入10mlNO2气体并封闭尖端,快速将活塞推至5ml处,其颜色变化是( )
| A. | 变深 | B. | 变浅 | C. | 先变深后变浅 | D. | 先变浅后变深 |
16.下列实验能成功的是( )
| A. | 用3体积的乙醇与l体积的浓H2SO4混合加热到170℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)在启普发生器中制乙炔 | |
| D. | 以硫酸、碳酸钠、苯酚钠溶液为试剂,验证酸性强弱关系:硫酸>碳酸>石炭酸 |
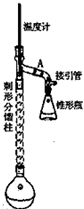 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下: