题目内容
2.短周期元素X、Y、Z、W的原子序数依次增大.X的原子半径比Y的小,且X与Y的最外层电子数之和等于Z的最外层电子数.X与W同主族,Z是地壳中含量最高的元素.下列说法不正确的是( )| A. | 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) | |
| B. | 元素Z、W的简单离子的电子层结构相同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | X、Y两种元素可形成分别含有10e-和18e-的化合物 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的元素,则Z为O元素;由原子序数可知,Y处于第二周期,而X的原子半径比Y的小,则X只能处于第一周期,故X为H元素;X与W同主族,W原子序数大于氧,故W为Na;X与Y的最外层电子数之和等于Z的最外层电子数,则Y原子最外层电子数为6-1=5,故Y为N元素,据此解答.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的元素,则Z为O元素;由原子序数可知,Y处于第二周期,而X的原子半径比Y的小,则X只能处于第一周期,故X为H元素;X与W同主族,W原子序数大于氧,故W为Na;X与Y的最外层电子数之和等于Z的最外层电子数,则Y原子最外层电子数为6-1=5,故Y为N元素.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,所有元素中H原子半径最小,故原子半径:r(Na)>r(N)>r(N)>r(O),故A正确;
B.元素Z、W的简单离子分别为O2-、Na+,离子核外均含有10个电子,离子的电子层结构相同,故B正确;
C.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性Y(N)<Z(O),所以Z的气态简单氢化物的热稳定性比Y的强,故C错误;
D.X、Y两种元素可形成NH3、N2H4,分子中分别含有10e-和18e-,故D正确,
故选C.
点评 本题考查原子结构和元素周期律,推断元素是解题关键,熟练掌握同一周期、同一主族元素性质递变规律,题目难度不大.

练习册系列答案
相关题目
11.下列离子组合,能够大量共存的是( )
| A. | 酸性溶液中:Al3+、Fe3+、SO42-、SCN- | |
| B. | 透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | FeCl3溶液中:Na+、K+、SO42-、I- | |
| D. | 强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
14.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | 光气(COCl2) | B. | 六氟化硫 | C. | 三氯化硼 | D. | 五氯化磷 |
11.下列有机物分子中,所有原子一定不在同一平面内的是( )
| A. | 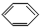 | B. | 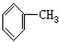 | C. | 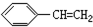 | D. | 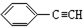 |
12.只需一种试剂即可将苯酚溶液、四氯化碳、己烯、甲苯四种无色液体区分开来,该试剂是( )
| A. | 新制Cu(OH)2悬浊液 | B. | KMnO4溶液 | C. | 溴水 | D. | FeCl3溶液 |
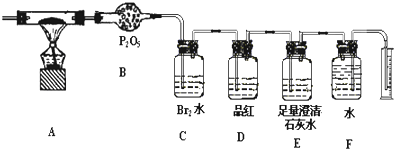

 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,
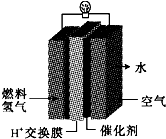
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车, 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: