题目内容
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
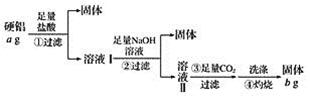
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
【答案】AlCl3、MgCl2、HCl Na[Al(OH)4]、NaCl、NaOH [Al(OH)4]-+CO2=Al(OH)3↓+HCO3— ![]()
【解析】
由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体为Cu、Si,溶液中含AlCl3、MgCl2以及过量的盐酸,②加足量的NaOH,过滤得到的沉淀为Mg(OH)2,溶液中主要含Na[Al(OH)4]、与过量盐酸反应生成的氯化钠和过量的氢氧化钠,③通足量的二氧化碳,反应生成Al(OH)3,④灼烧氢氧化铝分解得到Al2O3。
(1)根据分析可知溶液Ⅰ中的溶质为AlCl3、MgCl2、HCl;溶液Ⅱ中的溶质为Na[Al(OH)4]、NaCl、NaOH,故答案为:AlCl3、MgCl2、HCl;Na[Al(OH)4]、NaCl、NaOH;
(2)第③步通入二氧化碳与[Al(OH)4]-反应生成氢氧化铝沉淀,故答案为:[Al(OH)4]-+CO2=Al(OH)3↓+HCO3—;
(3)因铝在反应前后守恒,最后得到的固体Al2O3中铝的质量就是铝合金中的铝的质量,则铝的质量为![]() ,样品质量为ag,所以铝的质量分数=
,样品质量为ag,所以铝的质量分数=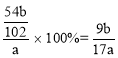 ,故答案为:
,故答案为:![]() 。
。

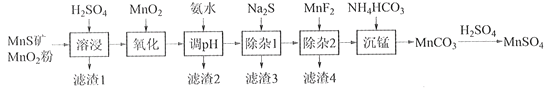
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
【题目】如图所示,利用培养皿探究NH3的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应产生了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥红石蕊试纸不变色,湿润红石蕊试纸变蓝 | NH3是一种可溶性碱 |
A.AB.BC.CD.D