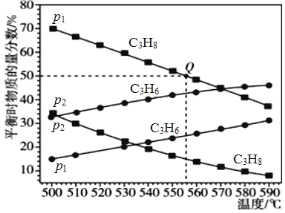
题目内容
【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
(2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
(4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。
【答案】草酸亚铁不溶于水 强于 产生蓝色沉淀 继续滴加K3[Fe(CN)6]溶液(或至不再沉淀),静置,取上层清液滴加酸性KMnO4 溶液 紫色褪去 e→b→a 锥形瓶、玻璃棒 CO2和Fe2(SO4)3 ![]() -8
-8
【解析】
由草酸亚铁晶体化学式FeC2O4·xH2O可知,FeC2O4·xH2O中铁元素的化合价为+2价,碳元素的化合价为+3价,其中Fe2+和C2O42-均具有还原性,能使酸性KMnO4 溶液褪色,检验Fe2+可滴加K3[Fe(CN)6]溶液,若产生蓝色沉淀,则说明含有Fe2+;若测定x值,可根据氧化还原反应原理,以0.1000 mol·L-1 的酸性KMnO4 溶液为标准液进行滴定,根据反应定量关系,计算x值,以此解答。
Ⅰ.(1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静置有淡黄色沉淀,上层清液无色,说明草酸亚铁不溶于水,
因此,本题正确答案为:草酸亚铁不溶于水;
(2)继续加入2mL稀硫酸,振荡,固体溶解,溶液变为浅绿色,草酸亚铁溶于硫酸,说明硫酸酸性强于草酸,
因此,本题正确答案为:强于;
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液,能够证明含有Fe2+,说明现象为产生蓝色沉淀,
因此,本题正确答案为:产生蓝色沉淀;
(4)若要证明H2C2O4 或C2O42-具有还原性,则可用酸性KMnO4 溶液,若褪色,则可证明,但Fe2+的存在对检验有干扰,需要滴加K3[Fe(CN)6]溶液使Fe2+完全转化为沉淀后,取上层清液进行实验,可排除Fe2+的干扰,所以有关操作和现象是继续滴加K3[Fe(CN)6]溶液(或至不再沉淀),静置,取上层清液滴加酸性KMnO4 溶液,紫色褪去,
因此,本题正确答案为:继续滴加K3[Fe(CN)6]溶液(或至不再沉淀),静置,取上层清液滴加酸性KMnO4 溶液;紫色褪去;
Ⅱ.(5)滴定管在使用前应检查是否漏水,后清洗干净,为避免误差,应用标准溶液润洗,润洗后盛装标准溶液,排除气泡并调节液面至0或0刻度以下,记录初始读数,然后开始滴定实验,滴定过程中观察锥形瓶中溶液颜色的变化,实验结束后,记录数据,因此正确顺序为:cebad。
因此,本题正确答案为:e→b→a;
(6)为了减少样品的损失,溶解时最适合的玻璃仪器是锥形瓶、玻璃棒;滴定时KMnO4为氧化剂,将FeC2O4·xH2O用硫酸溶解后的溶液中的Fe2+氧化为Fe3+,将C2O42-氧化为CO2,KMnO4被还原为Mn2+,所以氧化产物是CO2和Fe2(SO4)3,
因此,本题正确答案为:CO2和Fe2(SO4)3;
(7)根据得失电子守恒,得反应物的关系式为:5FeC2O4![]() 3 KMnO4,
3 KMnO4,
n(FeC2O4)=![]() n(KMnO4)=
n(KMnO4)=![]()
![]() 0.1000 mol·L-1
0.1000 mol·L-1![]() (20.50-0.50)
(20.50-0.50)![]() 10-3L=
10-3L=![]() mol,
mol,
根据公式m=nM,得![]() mol
mol![]() (144+18x)g/mol=mg,
(144+18x)g/mol=mg,
解得:x=![]() =
=
因此,本题正确答案为:![]() -8。
-8。

 巧学巧练系列答案
巧学巧练系列答案【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉