题目内容
【题目】丙烯是重要的有机化工原料,丙烷脱氢制丙烯具有显著的经济价值和社会意义。反应原理如下:C3H8(g)![]() C3H6(g)+H2(g) △H1
C3H6(g)+H2(g) △H1
(1)一定温度下,向 10 L 恒容密闭容器中充入 2 mol C3H8 发生反应,经过 10 min达到平衡状态,测得平衡时气体压强是开始的 1.75 倍。
①0 ~ 10 min内丙烯的生成速率υ(C3H6) =_________,C3H8 的平衡转化率为__________。
②下列情况能说明该反应达到平衡状态的是___________。
A.气体密度保持不变 B.[c(C3H6)·c(H2)]/c(C3H8)保持不变
C.△H1 保持不变 D.C3H8 分解速率与 C3H6 消耗速率相等
(2)总压强分别为 p1 和 p2 时,上述反应在不同温度下达到平衡,测得丙烷及丙烯的物质的量分数如下图所示:
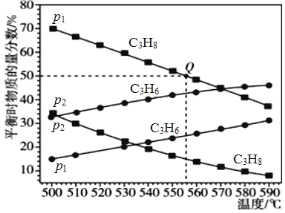
①压强:p1_____(填“>”或“<”)p2。
②为了提高反应速率和反应物的转化率,可采取的措施是_____。
③若 p1 = 0.1 MPa,起始时充入一定量的丙烷发生反应,计算 Q 点对应温度下该反应的平衡常数 Kp =_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④在 0.1 MPa、527℃条件下,向恒容密闭容器中通入丙烷和稀有气体,发生丙烷脱氢反应,随着![]() 的增加,丙烷脱氢转化率逐渐增大。试解释原因__________________________。
的增加,丙烷脱氢转化率逐渐增大。试解释原因__________________________。
(3)在实际生产中,还可能存在如下副反应:
C3H8(g)![]() C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
则△H3=_____。
【答案】0.015mol·L-1·min-1 或 0.015mol/(L·min) 75% B D > 升高温度 0.0125MPa 该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率 -136.5 kJ/mol
【解析】
(1) ①根据方程式可知:C3H8(g)![]() C3H6(g)+H2(g) 列出三段式,利用已知条件求出转化量和平衡量, 根据υ=
C3H6(g)+H2(g) 列出三段式,利用已知条件求出转化量和平衡量, 根据υ=![]() 求反应速率;根据转化率=
求反应速率;根据转化率=![]() ×100%,求转化率;
×100%,求转化率;
②根据化学平衡特征判断是否达到平衡状态;
(2)①由图可知,温度一定时,p1时丙烷的物质的量分数大于时p2,由方程式可知,压强越大,平衡逆向移动,丙烷的物质的量分数越大,所以压强:p1>p2;
②由图可知,随着温度升高,丙烷的物质的量分数降低,说明升高温度平衡向正反应方向进行,反应速率和反应物的转化率都增大;
③根据方程式可知:C3H8(g)![]() C3H6(g)+H2(g) 列出三段式,利用已知条件求出平衡时各物质的物质的量分数,进一步求出分压,再根据Kp =
C3H6(g)+H2(g) 列出三段式,利用已知条件求出平衡时各物质的物质的量分数,进一步求出分压,再根据Kp =![]() 求出平衡常数;
求出平衡常数;
④由反应方程式C3H8(g)![]() C3H6(g)+H2(g)可知,该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率,
C3H6(g)+H2(g)可知,该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率,
(3)将反应编号,根据盖斯定律,△H3=△H4-△H2 =-54.8 kJ/mol-81.7 kJ/mol=-136.5 kJ/mol。
(1) 根据方程式可知:
C3H8(g)![]() C3H6(g)+H2(g)
C3H6(g)+H2(g)
起始量(mol) 2 0 0
变化量(mol) x x x
平衡量 (mol) 2-x x x
根据阿伏加德罗定律:等温等容条件下,气体压强之比等于物质的量之比,则:
![]() =1.75,解得:x=1.5,
=1.75,解得:x=1.5,
①0 ~ 10 min 内丙烯的生成速率 υ(C3H6) =![]() = 0.015mol·L-1·min-1,
= 0.015mol·L-1·min-1,
C3H8 的平衡转化率为=![]() ×100%=75%,
×100%=75%,
②A.气体总质量和容积不变,所以气体密度始终保持不变,故其他密度保持不变不能说明达到平衡状态;
B.[c(C3H6)·c(H2)]/c(C3H8)即化学平衡常数,若保持不变,则说明达到平衡状态;
C.该反应的焓变是常量,焓变保持不变不能说明达到平衡状态;
D.C3H8 分解速率与 C3H6 消耗速率相等表示正逆反应速率相等,则说明达到平衡状态;
故选BD,
因此,本题正确答案为:0.015mol·L-1·min-1 或 0.015mol/(L·min) ;75% ;B D;
(2)①由图可知,温度一定时,p1时丙烷的物质的量分数大于时p2,由方程式可知,压强越大,平衡逆向移动,丙烷的物质的量分数越大,所以压强:p1>p2;
②由图可知,随着温度升高,丙烷的物质的量分数降低,说明升高温度平衡向正反应方向进行,反应速率和反应物的转化率都增大;
③假设起始时丙烷的物质的量为1mol,根据方程式可知:
C3H8(g)![]() C3H6(g)+H2(g)
C3H6(g)+H2(g)
起始量(mol) 1 0 0
变化量(mol) y y y
平衡量 (mol) 1-y y y
Q点:丙烷的物质的量分数为50%,则![]() ,则C3H8(g)、C3H6(g)、H2(g) 平衡时的物质的量分数分别为:
,则C3H8(g)、C3H6(g)、H2(g) 平衡时的物质的量分数分别为:![]() 、
、![]() 、
、![]() ,
,
则Q 点对应温度下该反应的平衡常数 Kp =![]() =
= =0.0125MPa,
=0.0125MPa,
④由反应方程式C3H8(g)![]() C3H6(g)+H2(g)可知,该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率,
C3H6(g)+H2(g)可知,该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率,
因此,本题正确答案为:> ;升高温度;0.0125MPa;该反应是气体分子数增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率;
(3)将反应编号: ②C3H8(g)![]() C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
C2H4(g)+CH4(g) △H2 = +81.7 kJ/mol
③C2H4(g)+H2(g)![]() C2H6(g) △H3
C2H6(g) △H3
④C3H8(g) +H2(g)![]() CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
CH4(g)+C2H6(g) △H4 = -54.8 kJ/mol
根据盖斯定律,④-②=③,则△H3=△H4-△H2 =-54.8 kJ/mol-81.7 kJ/mol=-136.5 kJ/mol,
因此,本题正确答案为:-136.5 kJ/mol。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
(2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
(4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。




