题目内容
【题目】下列属于水解反应的离子方程式为( )
A.碳酸钠溶液呈碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B.氯化铝溶液呈酸性:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.硫氢化钠溶液呈碱性:HS-+H2O![]() S2-+H3O+
S2-+H3O+
D.H2SO3溶液呈酸性:H2SO3![]() H++HSO
H++HSO![]()
【答案】B
【解析】
A.碳酸钠溶液呈碱性,碳酸根离子分步水解:CO32-+H2O![]() HCO3-+2OH-,故A错误;
HCO3-+2OH-,故A错误;
B.多元弱碱一步水解,氯化铝溶液呈酸性:Al3++3H2O![]() Al(OH)3+3H+,故B正确;
Al(OH)3+3H+,故B正确;
C.HS-+H2O![]() S2-+H3O+是电离方程式,硫氢化钠溶液呈碱性:HS-+H2O
S2-+H3O+是电离方程式,硫氢化钠溶液呈碱性:HS-+H2O![]() OH-+H2S,故C错误;
OH-+H2S,故C错误;
D.H2SO3溶液呈酸性,是因为弱酸电离:H2SO3![]() H++HSO
H++HSO![]() ,不是水解,故D错误;
,不是水解,故D错误;
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
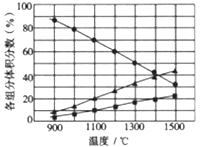
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
【题目】Ⅰ.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中, 采用废易拉罐(主要成分为 Al,含有少量的 Fe、Mg 杂质)制备明矾的过程如下图所示。 回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用______________(填标号)。
a.HCl 溶液 b.H2SO4 溶液 c.氨水 d.NaOH 溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_________________________。
(3)沉淀 B 的化学式为______________________
II.毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O 的流程如下:

(4)毒重石用盐酸浸取前需充分研磨,目的是_________________________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(5)滤渣Ⅱ中含 (填化学式)。加入 H2C2O4 时应避免过量,原因是_________________________________。已知:Ksp(BaC2O4) =1.6×10-7, Ksp(CaC2O4)=2.3×10-9