ƒøƒ⁄»ð
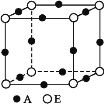
°æƒø°ø“—÷™A°¢B°¢C°¢D°¢E∂º «÷Ð∆⁄±Ì÷–«∞Àƒ÷Ð∆⁄µƒ‘™Àÿ,«“‘≠◊”–Ú ˝“¿¥Œ‘ˆ¥Û,∆‰÷–A‘≠◊”∫ÀÕ‚”–»˝∏ˆŒ¥≥…∂‘µÁ◊”;A”ÎBø…–Œ≥…¿Î◊”ªØ∫œŒÔB3A2;C‘™Àÿ «µÿø«÷–∫¨¡ø◊Ó∏þµƒΩ Ù‘™Àÿ;D‘≠◊”∫ÀÕ‚µƒM≤„÷–”–¡Ω∂‘≥…∂‘µÁ◊”;E‘≠◊”∫ÀÕ‚◊ÓÕ‚≤„÷ª”–1∏ˆµÁ◊”,∆‰”ý∏˜≤„µÁ◊”æ˘≥‰¬˙°£«Î∏˘æð“‘…œ–≈œ¢,ªÿ¥œ¬¡–Œ Â(¥Ã‚ ±,A°¢B°¢C°¢D°¢E”√À˘∂‘”¶µƒ‘™Àÿ∑˚∫≈±Ì æ):
(1)±»E∫ÀÕ‚µÁ◊” ˝…Ÿ5µƒ‘™Àÿµƒ‘≠◊”∫ÀÕ‚µÁ◊”≈≈≤º Ω « ,A°¢B°¢C°¢Dµƒµ⁄“ªµÁ¿ÎƒÐ”…–°µΩ¥ÛµƒÀ≥–ÚŒ™ °£
(2)Bµƒ¬»ªØŒÔµƒ»€µ„‘∂∏þ”⁄Cµƒ¬»ªØŒÔµƒ»€µ„,¿Ì”… « °£
(3)Aµƒ«‚ªØŒÔ Ù”⁄ (ÃÓ°∞º´–‘°±ªÚ°∞∑«º´–‘°±)∑÷◊”,DµƒµÕº€—ıªØŒÔ∑÷◊”µƒ¡¢ÃÂππ–Õ « °£
(4)A°¢E–Œ≥…µƒƒ≥÷÷ªØ∫œŒÔµƒæß∞˚Ω·ππ»ÁÕºÀ˘ æ,‘Ú∆‰ªØ—ß ΩŒ™ (√ø∏ˆ«Úæ˘±Ì æ1∏ˆ‘≠◊”)°£
°æ¥∞∏°ø(1)1s22s22p63s23p63d54s1(ªÚ[Ar]3d54s1) Al<Mg<S<N
(2)MgCl2Œ™¿Î◊”æßÃÂ∂¯AlCl3Œ™∑÷◊”æßà(3)º´–‘ V–Œ (4)CuN3
°æΩ‚Œˆ°øA‘≠◊”∫ÀÕ‚”–»˝∏ˆŒ¥≥…∂‘µÁ◊”,ø…“‘Õ∆∂œŒ™N;A”ÎBø…–Œ≥…¿Î◊”ªØ∫œŒÔB3A2,ø…“‘Õ∆∂œBŒ™Mg;C‘™Àÿ «µÿø«÷–∫¨¡ø◊Ó∏þµƒΩ Ù‘™Àÿ,º¥Œ™Al;D‘≠◊”∫ÀÕ‚µƒM≤„÷–”–¡Ω∂‘≥…∂‘µÁ◊”,ø…“‘Õ∆∂œDŒ™S;E‘≠◊”∫ÀÕ‚◊ÓÕ‚≤„÷ª”–1∏ˆµÁ◊”,∆‰”ý∏˜≤„µÁ◊”æ˘≥‰¬˙,ø…“‘Õ∆∂œEŒ™Cu,Cuµƒ∫ÀÕ‚µÁ◊” ˝Œ™29,±»∆‰∫ÀÕ‚µÁ◊” ˝…Ÿ5µƒ «Cr‘™Àÿ°£DµƒµÕº€—ıªØŒÔ «SO2£¨SO2µƒº€≤„µÁ◊”∂‘=2+![]() °¡£®6-2°¡2£©=3£¨∫¨”–“ª∏ˆπ¬µÁ◊”∂‘£¨À˘“‘∑÷◊”ø’º‰ππ–Õ «V–Œ£¨π ¥∞∏Œ™£∫sp2£¨V–Œ£ª£®4£©∏√æß∞˚÷–∞◊…´«Ú∏ˆ ˝=
°¡£®6-2°¡2£©=3£¨∫¨”–“ª∏ˆπ¬µÁ◊”∂‘£¨À˘“‘∑÷◊”ø’º‰ππ–Õ «V–Œ£¨π ¥∞∏Œ™£∫sp2£¨V–Œ£ª£®4£©∏√æß∞˚÷–∞◊…´«Ú∏ˆ ˝=![]() °¡8=1£¨∫⁄…´–°«Ú∏ˆ ˝=12°¡
°¡8=1£¨∫⁄…´–°«Ú∏ˆ ˝=12°¡![]() =3£¨N‘™Àÿ–Œ≥…µƒ∏∫º€ «-3º€£¨À˘“‘∏√æß∞˚÷–∫¨”–3∏ˆ—«Õ≠¿Î◊”1∏ˆN¿Î◊”£¨À˘“‘∆‰ªØ—ß ΩŒ™Cu3N£¨π ¥∞∏Œ™£∫Cu3N£Æ
=3£¨N‘™Àÿ–Œ≥…µƒ∏∫º€ «-3º€£¨À˘“‘∏√æß∞˚÷–∫¨”–3∏ˆ—«Õ≠¿Î◊”1∏ˆN¿Î◊”£¨À˘“‘∆‰ªØ—ß ΩŒ™Cu3N£¨π ¥∞∏Œ™£∫Cu3N£Æ

°æƒø°øCO2 «‘Ï≥…»´«Ú∆¯∫Ú±‰≈صƒ÷˜“™∆¯Ã£¨Õ¨ ±“≤ «“ª÷÷¿¥‘¥∑·∏ª°¢º€∏ҵաƵƒÃº◊ ‘¥°£÷–ø∆‘∫∏£Ω®ŒÔππÀ˘–ªø¸º∞∆‰Õ≈∂”¿˚”√µÁƒÐΩ´CO2∏þ–ß◊™ªØŒ™CO£¨CO∫ÕH2ø……˙≤˙”≈÷ »º¡œ∫Õ∂ý÷÷ªØπ§≤˙∆∑£¨ µœ÷ú◊ ‘¥µƒ—≠ª∑¿˚”√°£
£®1£©“—÷™∑¥”¶π˝≥Ã÷–ƒÐ¡ø±‰ªØ»Áœ¬±Ì∫Õ«˙œþÕºÀ˘ æ£∫
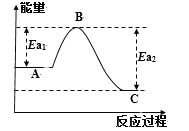
∑¥”¶ | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ¶§H(kJ/mol) |
¢Ÿ | 2CO(g)+O2(g) | 2CO2(g) | £ø | 2389 | -566 |
¢⁄ | 2H2(g)+O2(g) | 2H2O(l) | 1480 | £ø | -571.6 |
¢€ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ¶§H3 |
∑¥”¶¢€ µƒ¶§H3=_________kJ/mol°£
CO(g) + 2H2(g) ![]() CH3OH(l) ¶§H4=_______kJ/mol£ª¥À∑¥”¶÷–£¨”–¿˚”⁄÷∏þH2∆Ω∫‚◊™ªØ¬ µƒÃıº˛ «_______£®ÃÓ◊÷ƒ∏£©°£
CH3OH(l) ¶§H4=_______kJ/mol£ª¥À∑¥”¶÷–£¨”–¿˚”⁄÷∏þH2∆Ω∫‚◊™ªØ¬ µƒÃıº˛ «_______£®ÃÓ◊÷ƒ∏£©°£
A£Æ∏þŒ¬µÕ—π B£ÆµÕŒ¬∏þ—π
C£Æ∏þŒ¬∏þ—π D£ÆµÕŒ¬µÕ—π
£®2£©‘⁄≤ªÕ¨µƒµÁ—πœ¬£¨CO2°¢H2OªÏ∫œµÁΩ‚◊™ªØŒ™CO°¢H2µƒµÁ¡˜–߬ »ÁÕºÀ˘ 森◊¢£∫µÁ¡˜–߬ ![]() °¡100%£©£∫
°¡100%£©£∫

¢Ÿ”…Õºø…÷™…˙≥…CO∫ÕH2”–œýª•/span>_______£®ÃÓ°∞¥ŸΩ¯°±°¢°∞“÷÷∆°±ªÚ°∞ŒÞ”∞œÏ°±£©◊˜”√°£
¢⁄”√¥À∑®…˙≤˙µƒCO∫ÕH2∫œ≥…CH3OH£¨Œ™ πCO∫ÕH2¿˚”√¬ ◊Ó∏þ£¨µÁΩ‚ ±”¶øÿ÷∆µÁ—π‘⁄________ V◊Û”“£®—°ÃÓ5°¢15°¢23°¢25°¢30£©°£
£®3£©‘⁄300°Ê ±£¨Ω´0.60molCO°¢1.40molH2≥‰»Î4L√б’»ð∆˜÷–£¨‘⁄∫„Œ¬∫„»ðœ¬∑¢…˙∑¥”¶CO(g) + 2H2(g) ![]() CH3OH(g) °˜H<0£¨º◊¥ºµƒŒÔ÷ µƒ¡ø≈®∂»ÀÊ ±º‰µƒ±‰ªØ»ÁÕºÀ˘ æ£∫
CH3OH(g) °˜H<0£¨º◊¥ºµƒŒÔ÷ µƒ¡ø≈®∂»ÀÊ ±º‰µƒ±‰ªØ»ÁÕºÀ˘ æ£∫

¢ŸÕº÷–≈–∂œ∑¥”¶µΩ¥Ô∆Ω∫‚◊¥Ã¨µƒ“¿æð «________________°£
¢⁄ 5minƒ⁄H2µƒ∆Ωæ˘∑¥”¶ÀŸ¬ v(H2) £Ω________mol/(Lmin)°£
¢€ »Ù‘⁄500°ÊÃıº˛œ¬£¨Ω´1.00molCO°¢0.50mol H2∫Õ0.50mol CH3OH≥‰»Î»ðª˝Œ™2Lµƒ√б’»ð∆˜÷–£¨¥À ±∑¥”¶Ω´_______£®ÃÓ◊÷ƒ∏£©°£
A£Æ’˝∑¥”¶∑ΩœÚ∑¥”¶ B£ÆƒÊ∑¥”¶∑ΩœÚ∑¥”¶
C£Æ¥ÔµΩ∆Ω∫‚ D£ÆŒÞ∑®≈–∂œ
°æƒø°øŒ¬∂»Œ™T°Ê ±£¨œÚV Lµƒ√б’»ð∆˜÷–≥‰»Î“ª∂®¡øµƒA∫ÕB£¨∑¢…˙µƒ∑¥”¶Œ™A(g)£´B(g)![]() C(s)£´xD(g)°°¶§H£æ0£¨»ð∆˜÷–A°¢B°¢DµƒŒÔ÷ µƒ¡ø≈®∂»ÀÊ ±º‰µƒ±‰ªØ»Á±ÌÀ˘ æ°£œ¬¡–Àµ∑®≤ª’˝»∑µƒ «(°°°°)
C(s)£´xD(g)°°¶§H£æ0£¨»ð∆˜÷–A°¢B°¢DµƒŒÔ÷ µƒ¡ø≈®∂»ÀÊ ±º‰µƒ±‰ªØ»Á±ÌÀ˘ æ°£œ¬¡–Àµ∑®≤ª’˝»∑µƒ «(°°°°)
±º‰ | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
AµƒŒÔ÷ µƒ¡ø≈®∂»(mol°§L£≠1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
BµƒŒÔ÷ µƒ¡ø≈®∂»(mol°§L£≠1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
DµƒŒÔ÷ µƒ¡ø≈®∂»(mol°§L£≠1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.«∞10 minµƒ∆Ωæ˘∑¥”¶ÀŸ¬ v(D)£Ω0.3 mol°§L£≠1°§min£≠1
B£Æ∏√∑¥”¶µƒ∆Ω∫‚≥£ ˝±Ì¥Ô ΩŒ™K£Ω![]()
C£Æ»Ù¥ÔµΩ∆Ω∫‚ ±±£≥÷Œ¬∂»≤ª±‰£¨—πÀı»ð∆˜Ãª˝£¨∆Ω∫‚≤ª“∆∂Ø
D£Æ∑¥”¶÷¡15 min ±£¨∏ƒ±‰µƒÃıº˛ø…“‘ «ΩµµÕŒ¬∂»
