��Ŀ����
����Ŀ�����Ķ����в��ϣ��������С�⡣
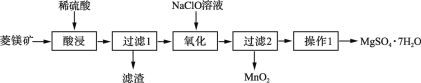
����Ĺ�ҵ��;�dz��㷺�����������컯�ʡ������⡢�����Һ�ȡ���ҵ������Ĺؼ�һ���ǽ�SO2����ΪSO3���÷�ӦΪ2SO2��O2![]() 2SO3�����÷�Ӧ����С����Ͷ�빤ҵ��������������ѧ���Dz��ϵظĽ���Ӧ�������ҵ�������Ĵ�������Ӧ�������¶ȣ��ɹ�������������������������ա�
2SO3�����÷�Ӧ����С����Ͷ�빤ҵ��������������ѧ���Dz��ϵظĽ���Ӧ�������ҵ�������Ĵ�������Ӧ�������¶ȣ��ɹ�������������������������ա�
��1��SO2��O2��һ�������·�Ӧ����SO3���÷�Ӧ���ڣ� ��
A.���Ϸ�ӦB.�ֽⷴӦC.�û���ӦD.���ֽⷴӦ
��2�����������еķ�Ӧ��������ԭ��Ӧ�������йظ÷�Ӧ��˵����ȷ���ǣ� ��
A.O2�ǻ�ԭ��B.SO2������
C.O2ʧȥ����D.SO2������ԭ��Ӧ
��3�����������еķ�Ӧ���ܱ������н��У����й��ڸ÷�Ӧ��˵����ȷ���ǣ� ��
A.�����¶��ܼ�����Ӧ����
B.SO2��O2��100%ת��ΪSO3
C.��СO2��Ũ���ܼӿ췴Ӧ����
D.ʹ��ǡ���Ĵ����ܼӿ췴Ӧ����
��4�����������еķ�ӦΪ���ȷ�Ӧ������˵����ȷ���ǣ� ��
A.�Ͽ���ѧ���ų�����
B.���ȷ�Ӧ������Ҫ����
C.�÷�Ӧ���淴Ӧ�����ȷ�Ӧ
D.�÷�Ӧ�ķ�Ӧ��������С���������������
���𰸡�
��1��A
��2��B
��3��D
��4��C
��������
��1��2SO2��O2![]() 2SO3���÷�Ӧ���ڻ��Ϸ�Ӧ����A��ȷ��
2SO3���÷�Ӧ���ڻ��Ϸ�Ӧ����A��ȷ��
������������ΪA��
��2��2SO2��O2![]() 2SO3��������ԭ��Ӧ��SO2���ϼ����ߣ�����������Ӧ�������������ϼ۽��ͣ�������ԭ��Ӧ������ԭ����B��ȷ��
2SO3��������ԭ��Ӧ��SO2���ϼ����ߣ�����������Ӧ�������������ϼ۽��ͣ�������ԭ��Ӧ������ԭ����B��ȷ��
������������ΪB��
��3��A. �����¶��ܼӿ췴Ӧ���ʣ���A����
B. 2SO2��O2![]() 2SO3�ǿ��淴Ӧ�����SO2��O2������100%ת��ΪSO3����B����
2SO3�ǿ��淴Ӧ�����SO2��O2������100%ת��ΪSO3����B����
C. ��СO2��Ũ�Ȼή�ͷ�Ӧ���ʣ���C����
D. ʹ��ǡ���Ĵ����ܼӿ췴Ӧ���ʣ���D��ȷ��
������������ΪD��
��4��A. �Ͽ���ѧ��������������A����
B. ���ȷ�ӦҲ������Ҫ���ȣ�����̼ȼ����Ҫ���ȣ���B����
C. �÷�Ӧ���淴Ӧ�����ȷ�Ӧ����C��ȷ��
D. �÷�Ӧ�ķ�Ӧ�����������������������������D����
������������ΪC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ʽ�ζ���ȷ��ȡ 25.00mL ijδ֪Ũ�ȵ�������һ�ྻ����ƿ�У�Ȼ����0.2000molL��1 ������������Һ�ζ�(ָʾ��Ϊ��̪)���ζ�������£�
NaOH ��ʼ���� | NaOH �յ���� | |
��һ�� | 0.10mL | 18.60mL |
�ڶ��� | 0.30mL | 19.30mL |
������ | 0.50mL | 16.30mL |
(1)�����������ݿ��Լ������������ʵ���Ũ��Ϊ________molL��1��
(2)��ʽ�ζ���ʹ�õĵ�һ��������________
(3)���²�����ɲⶨ���ƫ�ߵ�ԭ�������________��
A.����ƿʱ��Һ�ν���
B.�ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
C.ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
D.�ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ
E.δ�ñ�Һ��ϴ��ʽ�ζ���
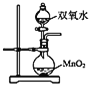
����Ŀ��ij�о���ѧϰС��Ի�ԭ������ˮ�����ķ�Ӧ��������п�ѧ̽�����䷴ӦԭΪ��3Fe+4H2O(g)![]() Fe3O4+4H2��Fe3O4+8HCl(Ũ)
Fe3O4+4H2��Fe3O4+8HCl(Ũ)![]() FeCl2+2FeCl3+4H2O��
FeCl2+2FeCl3+4H2O��
������ͼ��ʾʵ��װ�ã�ͬѧ�ǽ����˻�ԭ������ˮ������Ӧ��ʵ�顣

�Իش��������⣺
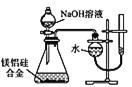
��1��ʵ����ʹ�÷���Һ����IJ�����___��ͼ��ʪ����������___��
��2������ͬѧΪ�˽�һ��ȷ����Ӧ�Ƿ�������ʵ����Թ��ڲ�����ɫ����ijɷֽ���������ʵ��̽����
ʵ����� | ʵ����� | ʵ������ |
�� | ȡ����������ɫ��������ձ��У���������Ũ���ᣬ�� | ��ɫ�������ܽ⣬�����ݲ�������Һ��dz��ɫ�� |
�� | �������ձ��еμӼ���KSCN��Һ������� | ��Һû�г���Ѫ��ɫ |
��������ʵ�飬���Dz�����ȫȷ����������ijɷ֣����϶���ȷ��������ɫ�����к��е�һ��������___��
��3������ͬѧҲ����������ʵ��̽����֤��ʵ����Թ��ڲ�����ɫ�����Ƿ����Fe3O4��
ʵ����� | ʵ����� | ʵ������ |
�� | ��ȡ14.4g������ɫ��������ձ��У���������Ũ���ᣬ�� | ��ɫ�������ܽ⣬�����ݲ�������Һ��dz��ɫ�� |
�� | �������ձ��м�����������ˮ������� | ��Һ�ʻ�ɫ |
�� | �������ձ��м�������NaOH��Һ�����ˡ�ϴ�ӡ�������� | �õ�21.4g���ɫ���� |
���������ͬѧ��ʵ���������������Ϊ������ɫ������һ��___(����������������������)Fe3O4��