题目内容
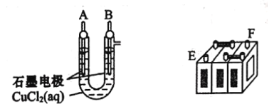
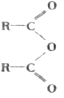
【题目】某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究,其反应原为:3Fe+4H2O(g)![]() Fe3O4+4H2,Fe3O4+8HCl(浓)
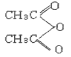
Fe3O4+4H2,Fe3O4+8HCl(浓)![]() FeCl2+2FeCl3+4H2O。
FeCl2+2FeCl3+4H2O。
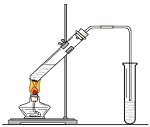
根据如图所示实验装置,同学们进行了还原铁粉与水蒸气反应的实验。

试回答下列问题:
(1)实验中使用肥皂液检验的产物是___;图中湿棉花的作用是___;
(2)甲组同学为了进一步确定反应是否发生,对实验后试管内残留黑色固体的成分进行了下列实验探究:
实验序号 | 实验操作 | 实验现象 |
① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中滴加几滴KSCN溶液,充分振荡 | 溶液没有出现血红色 |
根据上述实验,他们不能完全确定残留固体的成分,但肯定能确定残留黑色固体中含有的一种物质是___;
(3)乙组同学也进行了下列实验探究以证明实验后试管内残留黑色固体是否存在Fe3O4。
实验序号 | 实验操作 | 实验现象 |
① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色。 |
② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
请根据乙组同学的实验操作和现象,你认为残留黑色固体中一定___(填“存在”或“不存在”)Fe3O4。
【答案】氢气或H2 提供水蒸气 铁或Fe 存在
【解析】
(1)该反应进行产生氢气,反应的原料需要水蒸气;
(2)铁与盐酸反应有气泡冒出;
(3)残留黑色固体,假设全是铁,进过系列反应,生成的21.4g红褐色固体为Fe(OH)3,根据守恒法计算,如果相等,证明只有铁,如果不相等,则有Fe3O4。
(1)使用肥皂液的作用是收集并检验反应中生成的H2,故答案为氢气或H2;反应的原料需要水蒸气,湿棉花可提供水,故答案为:提供水蒸气;
(2)加入足量浓盐酸,黑色粉末逐渐溶解,溶液呈绿色,有少量气泡产生,说明一定有单质铁,故答案为铁或Fe;
(3)Fe~ Fe(OH)3,根据守恒法计算,生成的21.4g红褐色固体为Fe(OH)3,需要铁的质量=![]() =11.2g,而实际上称取14.4g残留黑色固体,故存在Fe3O4,故答案为存在。
=11.2g,而实际上称取14.4g残留黑色固体,故存在Fe3O4,故答案为存在。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案