题目内容
11.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
分析 W化合价为-2价,没有最高正化合价+6价,故W为氧元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为氮元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为镁元素,Y为铝元素.结合元素周期律知识解答该题.
解答 解:W化合价为-2价,没有最高正化合价+6价,W为氧元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为氮元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为镁元素,Y为铝元素.
A.同周期最原子序数增大,金属性减弱,故金属性Mg>Al,故A错误;
B.在放电条件下氮气与氧气可以化合生成NO,不能直接生成NO2,故B错误;
C.Y的最高价氧化物的水化物是氢氧化铝,不溶于弱碱氨水,故C错误;
D.一定件下,氧气可以将氨气反应可以生成氮气与水,故D正确;
故选:D.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键.

练习册系列答案
相关题目
1.下列有关化学用语表示正确的是( )
| A. | CO2的结构式O-C-O | |
| B. | S2-的结构示意图 | |
| C. | N2的电子式为  | |
| D. | 质子数为53,中子数为78的碘原子${\;}_{53}^{78}$I |
2.有机物A的结构简式如图,下列关于A的性质叙述中,错误的是( )
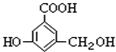

| A. | 不能发生水解反应 | |
| B. | A能与碳酸钠溶液反应 | |
| C. | A既能与羧酸反应,又能与醇反应 | |
| D. | A与氢氧化钠溶液完全反应时,两者物质的量之比是1:3 |
19.下列说法中正确的是( )
| A. | 如果找到合适的催化剂,就能够在不消耗能源的条件下从水中获得氢气 | |
| B. | 放热反应中反应物的总能量比生成物的总能量低 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 吸热反应在不加热的条件下也能发生 |
16.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应当n(NaHCO3):n[Ca(OH)2]=1:1时HCO3-完全转化为CaCO3 | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时铝元素以AlO2-形式存在 | |
| D. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,溶液中存在Fe2+ |
3.下列说法中,错误的是( )
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
20.关于CO2说法正确的是( )
| A. | 碳原子采取sp1杂化 | B. | CO2是正四面体型结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
1.下列说法正确的是( )
| A. | F、Cl、Br、I最高价氧化物对应水化物的酸性依次减弱 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素原子的最外层电子数等于元素的最高化合价 | |
| D. | Na、Mg、Al失电子能力和最高价氧化物对应水化物的碱性均依次减弱 |