题目内容
7.海水是巨大的资源宝库,可以进行综合利用.从海水中提取食盐和溴的过程如下.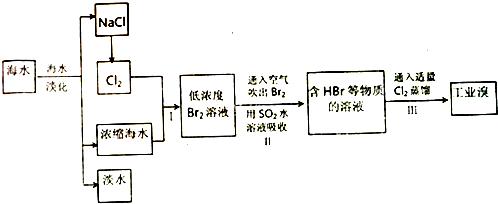
(Ⅰ)请写出一种海水淡化的方法:蒸馏法(或电渗析法、离子交换法)
(2)步骤Ⅰ获得Br2的离子方程式为Cl2+2Br-=2Cl-+Br2.
(3)步骤Ⅰ中己获得Br2,步骤Ⅱ中又将Br2还庳为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2.称为“空气吹出SO2吸收法”,其吸收率可达95%,有关反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-.
(5)步骤Ⅱ还可以利用单质溴在水中和在其它溶剂中溶解度的不同提取溴单质,此法称为“溶剂萃取法”.
下列试剂中,可用于提取溴的是②.
①乙醇 ②四氯化碳 ③醋酸
因工艺复杂设备投资大,经济效益低,所以工业上不采用此方法.
(6)根据上述反应判断SO2、CI2、Br2三种物质氧化性由强到弱的顺序是Cl2>Br2>SO2.
分析 通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,
(1)海水淡化的有蒸馏法、电渗析法、离子交换法等
(2)向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2;
(3)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素;
(4)利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr;
(5)萃取法提取溴单质利用互不相溶的溶剂,溶质在溶剂中的溶解度不同进行分离;
(6)氧化还原方程式中:氧化性:氧化剂大于氧化产物,氧化剂大于还原剂.
解答 解:通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2.
(1)海水淡化的有蒸馏法、电渗析法、离子交换法等,故答案为:蒸馏法(或电渗析法、离子交换法);
(2)步骤Ⅰ获得Br2的离子方程式:Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2;
(3)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,
故答案为:富集溴元素;
(4)在水溶液里溴和二氧化硫反应离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
(5)①乙醇在溴水中混溶不能分层,故①错误;
②四氯化碳不溶于水,比水重,溴单质在四氯化碳中溶解度大,可以萃取分液,故②正确;
③醋酸是弱酸和溴水混溶,不能分层,不能萃取,故③错误;
故答案为:②;
(6)Cl2+2Br-=Br2+2Cl-,因氧化性:氧化剂大于氧化产物,所以氧化性:Cl2>Br2;
Br2+SO2 +2H2O=H2SO4 +2HBr,因氧化性:氧化剂大于还原剂,所以氧化性:Br2>SO2;
故答案为:Cl2>Br2>SO2.
点评 本题考查物质的分离、提纯的综合应用,侧重于海水资源的综合利用的考查,从整体上把握溴的提纯过程,知道提纯过程中发生的反应及基本操作方法,再结合物质的性质分析解答,题目难度不大.

| A. | 在地壳中,C元素的含量位于第一位 | |
| B. | 由B、C、D三种元素组成的盐只有两种 | |
| C. | C元素位于元素周期表中的第3周期第ⅠA族 | |
| D. | B元素与氢元素形成化合物的化学式一定为H2B |
| A. | 硫化亚铁溶于稀盐酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4NCO3溶于过量的NaOH溶液中:HCO3-+OH+═CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 往氨水中滴加氢氧化钠溶液:OH-+H+═H2O |
| A. | PCl5 | B. | N2 | C. | BF3 | D. | H2O |
| A. | H2CO3电离:H2CO3?2H++CO32- | |
| B. | 将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | C12溶解于水:H2O+Cl2?2H++ClO-+Cl- | |
| D. | 向CuSO4溶液中通入H2S:Cu2++H2S═CuS↓+2H+ |
| A. | 1mol-CH3含有的电子数为10NA | |
| B. | 92gNO2气体中含有原子数为6NA | |
| C. | 1molC2H4分子中含共价单键总数为8NA | |
| D. | 标准状况下22.4LCHCl3中含有原子总数为5NA |
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 | |
| C. | 汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- | |
| B. | 漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | |
| C. | 向NH4Al(SO4)2溶液中逐渐滴入加入Ba(OH)2溶液恰好使SO42-反应完全: 2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| D. | FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| A. | 1摩尔H2O所含质子数为12NA | |
| B. | 2克氢气所含原子数为NA | |
| C. | 0.5摩尔单质铝与足量盐酸反应转移电子数为1.5NA | |
| D. | 标准状况下,1升水所含分子数为 NA |
