题目内容
18.能正确表示下列反应的离子方程式为( )| A. | 硫化亚铁溶于稀盐酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4NCO3溶于过量的NaOH溶液中:HCO3-+OH+═CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O→C6H5OH+CO32- | |
| D. | 往氨水中滴加氢氧化钠溶液:OH-+H+═H2O |
分析 A.硫化亚铁溶于稀盐酸中反应生成硫化氢和氯化亚铁;
B.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应;
C.苯酚的酸性大于碳酸氢根离子,二者反应生成碳酸氢根离子;
D.氨水与氢氧化钠溶液不发生反应.
解答 解:A.硫化亚铁溶于稀盐酸中生成氯化亚铁和硫化氢,反应的离子方程式为:FeS+2H+=Fe2++H2S↑,故A正确;
B.碳酸氢铵和过量的氢氧化钠溶液反应,生成碳酸钠、一水合氨和水,正确的离子方程式为:NH4++HCO3-+2OH-=NH3•H2O+H2O+CO32-,故B错误;
C.少量CO2通入苯酚钠溶液中,反应生成苯酚和碳酸氢根离子,正确的离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D.氨水与氢氧化钠溶液不反应,无法写出离子方程式,故D错误;
故选A.
点评 本题考查了离子方程式的书写,题目难度中等,明确离子方程式的书写原则为解答关键,C为易错点,注意苯酚的酸性大于碳酸氢根离子,反应生成的是碳酸氢根离子,不是碳酸根离子.

练习册系列答案
相关题目
8.常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,相同物质的量浓度的某一元碱(BOH)溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×1012,下列叙述正确的是( )
| A. | HA的pH=3;BOH的pH=13 | |
| B. | pH=a的HA溶液,稀释10倍,其pH=a+1 | |
| C. | 等体积的HA和BOH恰好完全反应,溶液的pH=7 | |
| D. | 相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同 |
9.下列说法正确的是( )
| A. | 室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 为保护地下钢管不受腐蚀,可将它与直流电源的负极相连 |
6.下列有关物质的用途错误的是( )
| A. | 水玻璃可用作木材防火剂 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 可用氢氟酸刻蚀玻璃 | D. | 石英是制造太阳能电池的常用材料 |
13.若表为周期表的一部分,其中M的单质与水反应时,水作还原剂,下列说法正确的是( )
| Y | X | M | ||
| Z | W |
| A. | 最低价离子半径Y、X、M依次减小 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 工业上通过电解Z的氯化物来冶炼Z单质 | |
| D. | Y、W、X三种元素最低价氢化物的沸点依次升高 |
3.化学家借助太阳能产生的电能和热能,用空气和水作原料合成了氨气.下列有关说法正确的是( )
| A. | 该合成中所有的电能和热能全部转化为化学能 | |
| B. | 该合成氨过程不属于氮的固定 | |
| C. | 空气、水、太阳能均为可再生资源 | |
| D. | 断裂N2中的N≡N键会释放出能量 |
10.下列叙述正确的是( )
| A. | 第三周期元素形成的简单离子中半径最小的是Na+ | |
| B. | 同周期元素(过渡元素和0族元素除外)从左到右,原子半径逐渐减小 | |
| C. | 带ⅦA族元素从上到小,其氢化物的稳定性逐渐增强 | |
| D. | 同主族元素从上到下,单质的熔点逐渐降低 |
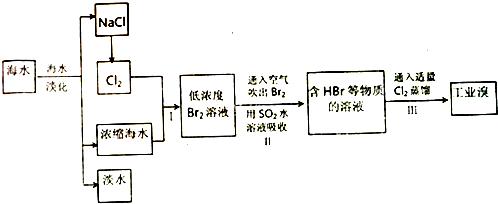
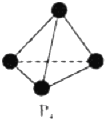 VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态.含VA族元素的化合物在研究和生回答下列问题:
VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态.含VA族元素的化合物在研究和生回答下列问题: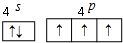 .N、P、As原子的第一电离能由大到小的顺序为N>P>As.
.N、P、As原子的第一电离能由大到小的顺序为N>P>As.