题目内容
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。
(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
(16分)
(1) ①CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ·mol-1(2分);
②c (2分) CH3OH+ H2O-6e-=CO2↑+6H+(2分);
③c(Na+)> c(HCO- 3)> c(OH-)> c(H+)> c(CO2- 3) (2分);
(2) bd (2分)
(3) 0.036mol·L-1·min-1或0.0006mol·L-1·s-1(2分);向正反应方向(2分);
(4) 1.01×10-5(2分)
解析试题分析:
(1)①根据盖斯定律①-②-③×4得到CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ·mol-1。②结合图像电池中质子移向正极,O2在正极反应。应从c通入,发生O2+4e-+4H+=2H2O,所以负极为CH3OH+ H2O-6e-=CO2↑+6H+。③溶液的pH=8应为溶质为碳酸氢钠,离子浓度由大到小的顺序是c(Na+)> c(HCO- 3)> c(OH-)> c(H+)> c(CO2- 3)。
(2)达到平衡状态时v(正)=v(逆),各物质的量不再改变,a、v(正)应该不在改变,错误。B、各物质的量不再改变,不再有能量变化,温度不变平衡常数不变,正确。c、各物质的量不再改变,错误。可知d、各物质的量不再改变,质量分数不变,正确。
(3)SO30.18mol,则转化的O2为0.09mol,v(O2)=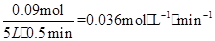 。
。
(4)NH3·H2O的电离平衡常数约为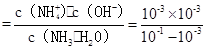 = 1.01×10-5。
= 1.01×10-5。
考点:考查盖斯定律应用、燃料电池、电解质溶液、化学平衡等相关知识。

电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C.
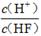 D.
D.
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
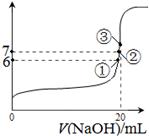
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
(14分)用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是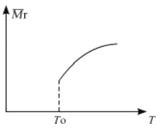
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCl) =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
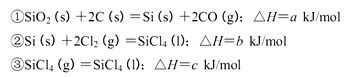
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
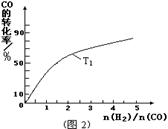
I.工业上可用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)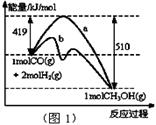
(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和2 mol H2 |
II.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为:BaSO4(s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。(写出计算过程,计算结果保留2位有效数字)
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 甲 | 乙 | 丙 | ||
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 | ||
| 达到平衡的时间/min | | 5 | 8 | ||
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | | ||
| NH3的体积分数 | ω1 | | ω3 | ||
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K= (用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)
 H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1第二步:H2NCOONH4(l)
 H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2 (4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
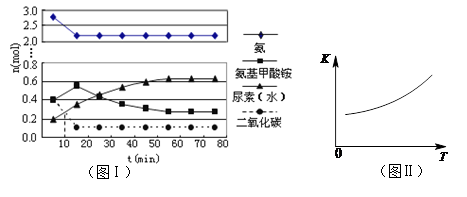
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为 (写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H ="a" kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2="bkJ·" kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H=" c" kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H= 。
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为 。
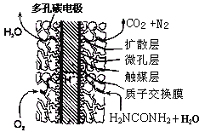
下列叙述错误的是
| A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同 |
| B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
| C.用碳酸钙粉末替代碳酸钙块状固体与盐酸反应,可以加快反应速率 |
| D.用AgNO3溶液可以鉴别KC1和KI |

 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。