题目内容
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
【答案】 Fe3+ 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3OH-= Fe(OH)3↓[或Fe3++3NH3·H2O = Fe(OH)3↓+3NH4+] 洗涤 冷却至室温 )0.07a或![]() 及其化简形式,如
及其化简形式,如![]() )
)
【解析】(1)向操作①的滤液中滴加KSCN溶液后变为红色,说明该滤液中含有Fe3+。(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,则②中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。(3)步骤③是将Fe3+转化为氢氧化铁沉淀,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓或Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,即过滤、洗涤、灼烧、冷却至室温、称量。(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量为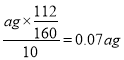 。
。

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案