题目内容
【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2)∶n(CO)分别为2∶1、5∶2时CO的转化率变化情况(如图1所示),则图中表示n(H2)∶n(CO)=2∶1的变化曲线为________(填“曲线a”或“曲线b”),原因是_________________。

(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 2 mol CO、6 mol H2 | a mol CO、b mol H2、c mol CH3OH(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
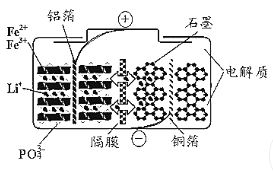
(5)CO与日常生产生活相关。

①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
【答案】CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1kJ/mol 曲线b H2的含量越低,CO的转化率越低 bc 0.25 1﹤c﹤2 CO-2e-+O2-=CO2 2CH3OH+CO-2e-==(CH3O)2CO+2H+
CH3OH(g) △H=-90.1kJ/mol 曲线b H2的含量越低,CO的转化率越低 bc 0.25 1﹤c﹤2 CO-2e-+O2-=CO2 2CH3OH+CO-2e-==(CH3O)2CO+2H+
【解析】
(1)利用盖斯定律:Ⅰ×![]() -Ⅱ×
-Ⅱ×![]() 得CO(g)+2H2(g)
得CO(g)+2H2(g) ![]() CH3OH(g) ,再计算△H;
CH3OH(g) ,再计算△H;
(2)n(H2):n(CO)=5:2时,相当于增大H2浓度,平衡正移,CO的转化率增大;
(3)a.催化剂参加化学反应才能加快反应速率;
b.在恒温恒压的平衡体系中充入氩气,体积增大,分压减小,平衡逆移;
c.反应速率与计量系数成正比;
(4)根据理想气体方程:PV=nRT,压强与物质的量成正比,先计算出平衡时各物质的量,再计算平衡常数K=c(CH3OH) ,最后根据等效平衡分析c的取值范围;
(5)①负极CO发生氧化反应与O2-结合生成CO32-,根据电子转移、电荷守恒书写负极电极反应式;
②阳极上是甲醇和一氧化碳反应失电子发生氧化反应生成(CH3O)2CO,根据电子转移、电荷守恒书写电极反应。
(1)已知:Ⅰ.3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol,Ⅱ.3CH3OH(g)
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol,Ⅱ.3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,由盖斯定律可知Ⅰ×
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,由盖斯定律可知Ⅰ×![]() -Ⅱ×
-Ⅱ×![]() 得CO(g)+2H2(g)
得CO(g)+2H2(g) ![]() CH3OH(g) ,则△H =(-
CH3OH(g) ,则△H =(-![]() ×301.3+
×301.3+![]() ×31.0) kJ/mol=-90.1kJ/mol,即CO与H2合成气态甲醇的热化学方程式为CO(g)+2H2(g)
×31.0) kJ/mol=-90.1kJ/mol,即CO与H2合成气态甲醇的热化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1kJ/mol;
CH3OH(g) △H=-90.1kJ/mol;
(2)n(H2):n(CO)=5:2时,相当于增大H2浓度,平衡正移,CO的转化率增大,则n(H2):n(CO)=2:1时H2的含量越低,平衡逆向移动,CO的转化率越低,即图中表示n(H2):n(CO)=2:1的变化曲线为曲线b;
(3)a.催化剂参加化学反应才能加快反应速率,故a错误;
b.在恒温恒压的平衡体系中充入氩气,体积增大,分压减小,平衡逆移,CH3OH的产率降低,故b正确;
c.根据反应速率与计量系数成正比,当2V正(CO)=V逆(H2)时,反应达到平衡,故c正确;
故答案为bc;
(4)已知甲中反应物投入量为:2moLCO、6molH2,则:
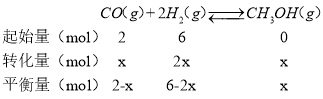
根据理想气体方程:PV=nRT,压强与物质的量成正比,即![]() =
=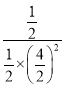 0.25;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量等于CO的物质的量为2mol,c 的物质的量不能低于平衡时的物质的量1mol,所以c的物质的量为:1<n(c)<2;
0.25;依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量等于CO的物质的量为2mol,c 的物质的量不能低于平衡时的物质的量1mol,所以c的物质的量为:1<n(c)<2;
(5)①负极CO发生氧化反应与O2-结合生成CO32-,负极电极反应式为:CO+2O2--2e-=CO32-;
②阳极上是甲醇和一氧化碳反应失电子发生氧化反应,根据电子转移、电荷守恒书写电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+。

【题目】实验小组同学对乙醛与新制的Cu(OH)2反应的实验进行探究。
实验Ⅰ:取2mL 10%的氢氧化钠溶液于试管中,加入5滴2%的CuSO4溶液和5滴5%的乙醛溶液,加热时蓝色悬浊液变黑,静置后未发现红色沉淀。
实验小组对影响实验Ⅰ成败的因素进行探究:
(1)探究乙醛溶液浓度对该反应的影响。
编号 | 实验Ⅱ | 实验Ⅲ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变红棕色,静置后底部有大量红色沉淀 | 加热,蓝色悬浊液变红棕色,静置后上层为棕黄色油状液体,底部有少量红色沉淀 |
已知:乙醛在碱性条件下发生缩合反应:CH3CHO+CH3CHO![]() CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
CH3CH=CHCHO+H2O ,生成亮黄色物质,加热条件下进一步缩合成棕黄色的油状物质。
① 能证明乙醛被新制的Cu(OH)2 氧化的实验现象是______。
② 乙醛与新制的Cu(OH)2 发生反应的化学方程式是______。
③ 分析实验Ⅲ产生的红色沉淀少于实验Ⅱ的可能原因:______。
(2)探究NaOH溶液浓度对该反应的影响。
编号 | 实验Ⅳ | 实验Ⅴ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,蓝色悬浊液变红棕色, 静置后底部有红色沉淀 |
依据实验Ⅰ→Ⅴ,得出如下结论:
ⅰ. NaOH溶液浓度一定时,适当增大乙醛溶液浓度有利于生成Cu2O。
ⅱ. 乙醛溶液浓度一定时,______。
(3)探究NaOH溶液浓度与乙醛溶液浓度对该反应影响程度的差异。
编号 | 实验Ⅵ | 实验Ⅶ |
实验方案 |
|
|
实验现象 | 加热,蓝色悬浊液变黑 | 加热,静置后底部有红色沉淀 |
由以上实验得出推论: ______。
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
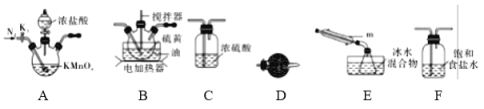
①仪器m的名称为____________,装置F中试剂的作用是____________。
②装置连接顺序:A→________→________→________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
![]()
①W溶液可以是____________(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________(用含V、m的式子表示)。
【题目】CO2的资源化利用一直是化学家们关注的重要课题,中科院大连化学物理研究所设计了一种新型多功能复合催化剂,成功地实现了CO2直接加氢制取高辛烷值汽油:5CO2(g)+16H2(g)=C5H12(l)+10H2O(l) ΔH=+a kJ/mol (反应①),该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知氢气的燃烧热为286 kJ/mol,若要利用H2的燃烧热求a的值,则还需要知道一个反应的ΔH,该反应是___________。反应①在一定条件下具有自发性,则a_____0(填“>”或“<”)。
(2)向某密闭容器中按一定投料比充入 CO2、H2,控制条件使其发生反应:5CO2(g)+16H2(g)![]() C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
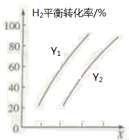
则X表示____________,Y1____________Y2(填“>”或“<”)。欲提高H2的平衡转化率并提高单位时间内C5H12(l)的产量,可采取的措施是_________(填两种)。
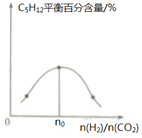
(3)控制一定温度、催化剂,按不同投料比[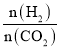 ]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
(4)在钌一铑双金属催化剂的作用下,CH3OH、CO2、H2可高效地转化为乙酸,反应方程式为CH3OH(g)+CO2(g)+H2(g)![]() CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
则反应开始到达平衡的过程中,v(CO2)=________kPa/min,Kp=_______span>kPa-1。
(5)碳捕捉技术的发展也有利于CO2在资源应用方面得到充分利用。常温下,若某次用NaOH溶液捕捉空气中的CO2所得溶液的pH=10,并测得溶液中c(HCO3-)=2c(CO32-),则Ka2(H2CO3)=_______mol/L。