题目内容
8.有CO和CO2的混合气体15g,通入足量的澄清石灰水中,最后得到沉淀物10g,则原混合气体中CO气体的质量和物质的量为多少?分析 生成的10g沉淀为碳酸钙,根据n=$\frac{m}{M}$可以计算出碳酸钙的物质的量,再根据C原子守恒可知混合气体中二氧化碳的物质的量,再根据m=nM计算出二氧化碳的质量,从而可计算出CO的质量、物质的量.
解答 解:CO和CO2的混合气体15g,通入足量的澄清石灰水中,最后得到沉淀物10g,该沉淀为碳酸钙,其物质的量为:$\frac{10g}{100g/mol}$=0.1mol,
根据C原子守恒,生成0.1mol碳酸钙需要 消耗二氧化碳的物质的量为0.1mol,
则混合气体中二氧化碳的质量为:44g/mol×0.1mol=4.4g,
所以混合气体中CO的质量为:15g-4.4g=10.6g,其物质的量为:$\frac{10.6g}{28g/mol}$=0.38mol,
答:原混合气体中CO气体的质量为10.6g,物质的量为0.38mol.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
19.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有( )
| A. | ①②⑥ | B. | ②③⑥ | C. | ①③④⑤ | D. | 全部 |
16.关于NO的下列叙述,不正确的是( )
| A. | NO可以是某些含低价氮物质的氧化产物 | |
| B. | NO可以是某些含高价氮物质的还原产物 | |
| C. | 已知亚硝酸钠的化学式是NaNO2,则NO不是亚硝酸酐 | |
| D. | NO2和NO都是红棕色气体 |
13.向30mL1mol•L-1的AlCl3溶液中逐渐加入浓度为4mol•L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为( )
| A. | 3mL | B. | 10mL | C. | 15mL | D. | 27.5mL |
20.能用离子方程式:CO32-+2H+═CO2↑+H2O来表示的是( )
| A. | 碳酸钡与盐酸反应 | B. | 碳酸钾溶液与醋酸溶液反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
17.X元素天然存在的一个原子中共有质子、中子及电子93个,其中35个粒子不带电,则X元素的该原子的相对原子质量约为( )
| A. | 35 | B. | 30 | C. | 64 | D. | 58 |
18.下列溶液一定显碱性的是( )
| A. | 溶液中无H+ | B. | 溶液中pH>7 | C. | 溶液中只有OH- | D. | 溶液中c(OH-)>c(H+) |
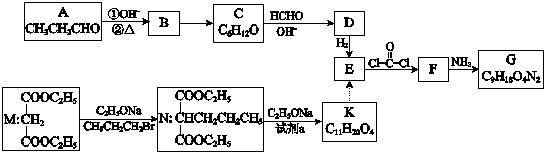
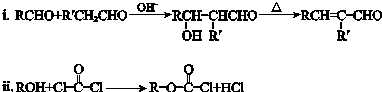
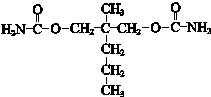 .
.