题目内容
18.下列溶液一定显碱性的是( )| A. | 溶液中无H+ | B. | 溶液中pH>7 | C. | 溶液中只有OH- | D. | 溶液中c(OH-)>c(H+) |
分析 A、任何溶液中都存在氢氧根离子;
B、在25℃时溶液的pH>7时溶液呈碱性;
C、任何溶液中都存在氢离子;
D、决定溶液显酸性、中性还是碱性,取决于溶液中c(H+)和c(OH-)的相对大小.
解答 解:A、无论酸溶液还是碱溶液中,都一定存在氢离子,决定溶液显酸性、中性还是碱性,取决于溶液中c(H+)和c(OH-)的相对大小,故A错误;
B、在25℃时溶液的pH>7时溶液呈碱性,本题未指明温度,故B错误;
C、无论酸溶液还是碱溶液中,都一定存在氢离子和氢氧根离子,故C错误;
D、溶液中c(OH-)>c(H+),溶液一定显示碱性,故D正确;
故选D.
点评 本题考查了溶液PH的计算、溶液酸碱性的判断,水的离子积的计算应用,题目难度不大,注意不能根据溶液的PH值大小判断溶液酸碱性,试题贴近高考,针对性强,有利于激发学生的学习兴趣和学习积极性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3中的化学键类型是共价键.
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强(或元素X的数值越小,元素的金属性越强);简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)请你预测Br与I元素的X数值的大小关系Br大于I.
(4)某化合物分子中含有S-N键,你认为该共享电子对偏向于N原子(填元素符号).
7.人造象牙主要成分的结构是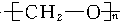 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )
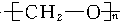 ,它是通过加聚反应制得的,则合成象牙的单体是( )
,它是通过加聚反应制得的,则合成象牙的单体是( )| A. | (CH3)2O | B. | CH3CHO | C. | HCHO | D. | C2H2和H2O |
8.下列气体溶于括号中的反应液不能形成喷泉的是( )
| A. | HCl (水) | B. | NH3(水) | ||
| C. | SO2(浓氢氧化钠溶液) | D. | Cl2(饱和食盐水) |
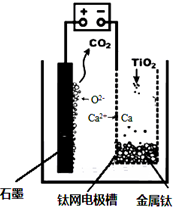 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O